理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g) CO2(g)+2H2O(1);△H<0 CO2(g)+2H2O(1);△H<0 |
B.HNO3(1)+NaOH(1) NaNO3(1)+H2O(1);△H<0 NaNO3(1)+H2O(1);△H<0 |
C.2H2(g)+O2(g) 2H2O(1);△H<0 2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)==3FeCl2(1);△H<0 |
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是_________________。
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为________________。
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH﹣﹣2e﹣=ZnO+H2O;Ag2O+H2O+2e﹣=2Ag+2OH﹣
根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag20极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是2Ag + 2H+ ="=" 2Ag+ + H2 ↑,则下列关于该装置的有关说法正确的是
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属银为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
铜锌原电池(如图)工作时,下列叙述正确的是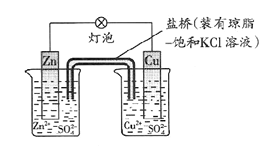
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列关于电化学的理解正确的是
| A.原电池一定是负极材料失电子,发生氧化反应 |
| B.电解池的电极材料一定不参与电极反应 |
| C.原电池的负极和电解池的阳极一定发生氧化反应 |
| D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是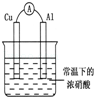
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
某学习小组依据反应:SO2(g)+ Cl2(g)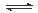 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
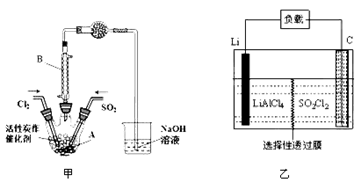
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是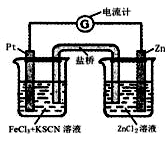
| A.正极反应为:Zn – 2e-→Zn2+ |
| B.盐桥中K+向右池移动 |
| C.Pt电极上有气泡出现 |
| D.左烧杯中溶液的红色变浅 |
试题篮
()