下列各组材料中,不能组成原电池的是 ( )
| |
A |
B |
C |
D |
| 两极材料 |
Zn片、石墨 |
Cu片、Ag片 |
Zn片、Cu片 |
Fe片、Cu片 |
| 插入溶液 |
硫酸溶液 |
硝酸银溶液 |
蔗糖溶液 |
稀盐酸 |
有如下两个反应: A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A B (填“能”或“不能”)不能设计成原电池的原因是
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是
②写出负极的电极反应式
③若导线上转移电子0.2mol,则负极质量变化是
关于如图所示的装置的叙述,正确的是:
| A.电流从锌片经导线流向铜片 |
| B.一段时间后,电解质溶液中的硫酸根浓度减少 |
| C.铜是正极,铜片上有气泡产生,锌片质量减少 |
| D.一段时间后,电解质溶液的酸碱性保持不变 |
关于下图电化学装置中的电极名称、材料及反应均可能正确的是
| A.阴极(Cu片)2C1――2e-=Cl2↑ |
| B.正极(石墨棒):Fe3+ +e-= Fe2+ |
| C.阳极(Cu片):4OH――4e-=2H2O+O2↑ |
| D.负极(Fe钉):Fe-3e-=Fe3+ |
如图
|
甲把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是( )
 卡片号:2009.3
卡片号:2009.3
 实验后的记录:
实验后的记录:
①Cu为阳极,Zn为阴极
②Cu极上有气泡产生
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
 ⑤电子流向是:Cu Zn
⑤电子流向是:Cu Zn
⑥正极反应式:Cu + 2e- = Cu2+
图甲 图乙
| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
原电池中发生的化学反应属于 ,原电池将 转化为 能。其中,电子流出的一极是原电池的 极,该极发生 反应,电子流入的一极是原电池的 极,该极发生 反应。原电池中电解质溶液的作用是 。
铜锌原电池(如图)工作时,下列叙述正确的是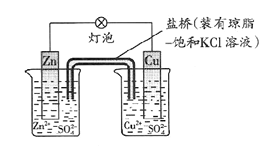
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列关于电化学的理解正确的是
| A.原电池一定是负极材料失电子,发生氧化反应 |
| B.电解池的电极材料一定不参与电极反应 |
| C.原电池的负极和电解池的阳极一定发生氧化反应 |
| D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是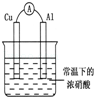
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
某学习小组依据反应:SO2(g)+ Cl2(g)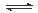 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是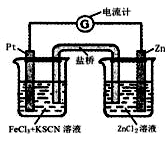
| A.正极反应为:Zn – 2e-→Zn2+ |
| B.盐桥中K+向右池移动 |
| C.Pt电极上有气泡出现 |
| D.左烧杯中溶液的红色变浅 |
下列有关说法中不正确的是
| A.将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 |
| B.高纯硅常用作光导纤维的原料 |
| C.用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |
试题篮
()