(10分)为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 |
电极材料 |
电解质溶液 |
电子流向 |
| ① |
Mg—Al |
HNO3(浓) |
Mg→Al |
| ② |
Mg—Al |
HCl(aq) |
Mg→Al |
| ③ |
Mg—Al |
NaOH(aq) |
Al→Mg |
| ④ |
Al—Cu |
HNO3(浓) |
Cu→Al |
根据以上表格内容回答:
(1)(4分)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作________,总反应:__________(同上)
(2)(6分)实验2中Mg电极反应式为__________________。
Al电极上的电极反应式为______________________,总的电池反应是_______________________。
如图,a和b均为金属棒,当电流计中指针发生偏转,下列说法正确的是
| A.电极a表面一定呈红色 |
| B.电极b作负极 |
| C.电极a或b其中有一极一定是金属铁 |
| D.该装置能量转化形式为化学能转化为电能 |
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是
| A.在①中溶液的Cu2+向铜棒移动 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
如图所示,A、B是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
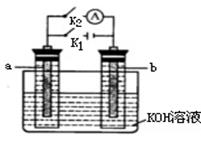
A.断开K2,闭合K1时,A极上的电极反应式为:4OH¯一4e¯=== O2↑十+2H2O
B.断开K2,闭合K1一段时间,溶液的pH要变大
C.断开K1,闭合K2时,B极上的电极反应式为: 2H++2e¯=== H2↑
D.断开K1,闭合K2时,OH¯向B极移动
某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
| A.正极反应为AgCl+e-===Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH)。已知0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出CH3OH(l)燃烧的热化学方程式 。
下图为两个原电池装置图,由此判断下列说法错误的是
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
传感器可以检测空气中SO2的含量,传感器工作原理如下图所示。下列叙述中正确的是
| A.b为电源的正极 |
B.负极反应式 Ag - e- + Cl-  AgCl AgCl |
| C.当电路中电子转移为5×10-5 mol时,进入传感器的SO2为 1.12 mL |
D.阴极的电极反应式是: +2H++2e- +2H++2e-  +2H2O +2H2O |
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是:
| |
X |
Y |
Z |
| A |
锌 |
铜 |
稀硫酸溶液 |
| B |
铜 |
铁 |
稀盐酸 |
| C |
锌 |
铜 |
硝酸银溶液 |
| D |
碳 |
锌 |
硝酸铜溶液 |
用CaCO3与稀盐酸反应制取CO2,部分时间段内产生气体的体积如图所示,下列说法正确的是
| A.OE段化学反应速率最快 |
| B.EF段收集CO2气体最多 |
| C.为了加快反应速率,可向溶液中滴入硫酸铜溶液 |
| D.分析OE、EF、FG三段,该反应为放热反应 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是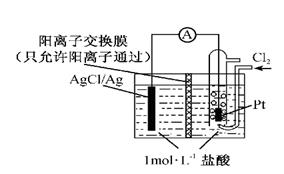
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 (用离子符号表示)。
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
(6)在101 kPa、25℃下,16 g 液态C2A4在D2中完全燃烧生成气体C2,放出312 kJ热量,则C2A4和D2反应的热化学方程式为 。
X、Y、Z、M、G五种元素分属三个短周期, 且原子序数依次增大。X、Z同主族, 可形成离子化合物ZX; Y、M同主族, 可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式), 非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 、 (写出其中两种物质的化学式,一种为单质,另一种为化合物)。
(4)ZX的电子式为 。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下图),反应原理为:
2Z+ FeG2 Fe+ 2ZG
Fe+ 2ZG
放电时, 电池的正极反应式为 ,充电时, (写物质名称)电极接电源的负极。
(10分) (Ⅰ)观察图A、B、C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) 、 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3mol•L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是 。
.W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大。Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的的调味品;X的简单气态氢化物水溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为_________,X的简单气态氢化物的电子式为_____________,W、Y、Z、M、G形成的简单离子的半径大小顺序是___________________(用相应的离子符号表示)。
(2)Y与M的氢化物中,热稳定性更好的是______(填化学式),原因是_______________
(3)由 W、Y、Z、M组成的两种盐(均含有以上四种元素)的溶液反应可产生MY2气体,写出其反应的离子方程式________________________
(4)如图,A、B两极均为惰性电极,a是Z与G形成的饱和溶液,实验开始 时,同时在两边各滴入几滴酚酞试液,则
①电解池中A极上的电极反应式为 。在A极附近观察到的现象是 。
②B电极上的电极反应式为 ,检验该电极反应产物的方法是______________________
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
A.X4沸点比P4(白磷)高,属于原子晶体
B.lmol X4气体转变为X2放出882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知生成1mol水蒸气时放热284kJ,写出X2W4 (g)和NO2(g)反应的热化学方程式__________________,已知H2O(l)==H2O(g) ΔH =+44kJ/mol,则16g X2W4 (g)与NO2反应生成液态水时放出的热量是________kJ。
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式_______________,指出电解质溶液中OH-离子向________极移动。
试题篮
()