(15分)开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l)ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于: CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0
CO(g)+3H2(g)ΔH>0
①该反应的平衡常数表达式K= ,一定条件下CH4的平衡转化率与温度、压强的关系如图a。则T1 T2(填“<”“>”或“=”下同),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。
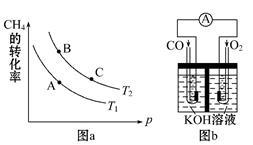
②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,不能说明该反应已经达到平衡状态的是 。
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3v正(CH4)=v逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。当有4mol电子通过导线时,消耗标准状况下的O2体积为 L ,此时电解质溶液的PH值 (填“变大”、“变小”或“不变”)
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO |
对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 。
(2)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

(3)1600℃时,反应2CO(g)+ O2(g) 2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应式 。
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 +2Ni(OH)2
Cd(OH)2 +2Ni(OH)2
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e— + OH- ="=" NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
下图为两个原电池装置图,由此判断下列说法错误的是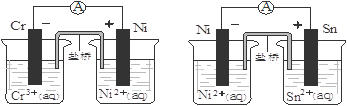
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是
| A.该装置实现化学能向电能的转化 |
| B.该电池的总反应为2NO + O2 = 2NO2 |
| C.NiO电极的电极反应式: NO + O2- - 2e—= NO2 |
| D.当有2.24L的O2参与反应时,转移了0.4mole— |
(11分)现有反应:
A.CaCO3 CaO+CO2↑ CaO+CO2↑ |
| B.Zn+H2SO4=ZnSO4+H2↑ |
C.C+CO2 2CO 2CO |
| D.2KOH+H2SO4=K2SO4+2H2O |
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合下图的是 (填反应序号)。

(2)在常温下,上述四个反应中可用于设计原电池的是 (填反应序号),根据该原电池回答下列问题:
①负极材料是 ,负极发生 (填“氧化”或“还原”)反应;正极反应式为 。
②当导线中有1 mol电子通过时,理论上发生的变化是 (填序号)。 (相对原子质量:H1,Zn65)
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如下图所示。

①m曲线表示锌与稀硫酸 (填“X”或“Y”)反应。
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是 (填序号)。
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42-)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验 装置 |
 |
 |
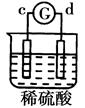 |
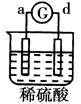 |
| 部分实验现象 |
a极质量减小b极质量增加 |
溶液中的SO42-向b极移动 |
d极溶解c极有气体产生 |
电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
如图是某同学设计的一个简易的原电池装置,回答下列问题。
(1)若a为镁、b为CuCl2,则正极材料为_____,负极上的电极反应式为_________。
(2)若a为镁、b为NaOH,则Mg极上发生________反应(填“氧化”或“还原”),负极上的电极反应式为_______________。
(3)若a为铜、b为浓硝酸,则电流的方向为____→___(填电极材料),正极上的电极反应式为______。
(4)上述事实表明,确定原电池中电极的正负时,不仅要考虑电极材料本身的性质,还要考虑________。
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl—KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列有关说法正确的是
| A.正极反应式:Ca+2Cl--2e-===CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.每转移0.1 mol电子,理论上生成20.7 g Pb |
| D.常温时,在正负极间接上电流表或检流计,指针不偏转 |
X、Y、Z、M、N代表五种金属,有以下化学反应:
(1)水溶液中X+Y2+===X2++Y;
(2)Z+2H2O(冷水)===Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-===M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化。
则这五种金属的活动性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<X<Y<Z | C.N<M<Y<X<Z | D.X<Z<N<M<Y |
由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是________
(2)原稀H2SO4的物质的量浓度是________
被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O===ZnO+2MnO(OH)下列说法正确的是
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023 |
| D.电池正极反应式为MnO2+e-+H2O===MnO(OH)+OH- |
如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是 
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体 |
试题篮
()