对于Fe-Cu-稀H2SO4组成的原电池中当有4mol电子通过导线时,则下列说法正确的是( )
| A.铁片溶解了56g | B.铜片上析出22.4L(标况下)气体 |
| C.电解质溶液的pH逐渐减小 | D.SO42-移向Fe电极 |
分析如图所示的四个原电池装置,其中结论正确的是 ( )
| A.①②中Mg作为负极,③④中Fe作为负极 |
| B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑ |
| C.③中Fe作为负极,电极反应为Fe-2e-===Fe2+ |
| D.④中Cu作为正极,电极反应式为2H++2e-===H2↑ |
下列关于原电池的叙述中正确的是 ( A )
| A.原电池能将化学能转变为电能 |
| B.原电池负极发生的电极反应是还原反应 |
| C.原电池在工作时其正极不断产生电子并经外电路流向负极 |
| D.原电池的电极只能由两种不同的金属构成 |
把a、b、c、d四块金属浸泡在稀H2SO4中,用导线两两相连可组成原电池。若a、b相连时,a为负极;c、d相连时,c为负极,a、c相连时,c为正极,b、d相连时,b为正极。则这四种金属的活泼性顺序由大到小为( )
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
下列说法正确的是( )
| A.原电池是把电能转化为化学能的装置 |
| B.原电池两极均发生氧化还原反应 |
| C.原电池中的阳离子向正极移动 |
| D.原电池中电子流出的一极是正极,发生氧化反应 |
把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两连接,可组成若干原电池。若 a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极。则下列说法正确的是
| A. b的活动性一定在氢之后 |
| B.若a与b相连,则a为原电池的正极 |
| C.若c与b相连,则b极上发生氧化反应 |
| D.若将稀H2SO4换为NaOH溶液,a、c分别为镁、铝,则a极上有气泡产生 |
如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,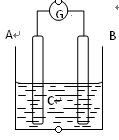
下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
有X、Y、Z、M四种金属,已知:M投入水中可与水剧烈反应;用X和Z作电极,稀硫酸作电解质溶液构成原电池时,Z有气泡产生; Y和Z的离子共存于电解液中电解,阴极析出Y。则这四种金属的活动性由强到弱的顺序是
| A.X > Z > Y > M | B.X > M > Z > Y | C.M > Y > Z > X | D.M > X > Z > Y |
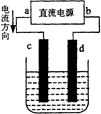 关于如图所示装置的叙述,正确的是
关于如图所示装置的叙述,正确的是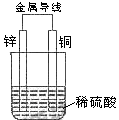
| A.Zn为负极,Cu为正极 |
B.正极反应为Zn-2e→ |
C.负极反应为Cu-2e→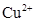 |
| D.该装置能将电能转化为化学能 |
下图为甲烷燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
| A.a电极是负极 |
| B.b电极的电极反应为:4OH- -4e- →2H2O +O2 ↑ |
| C.甲烷燃料电池是一种具有应用前景的绿色电源 |
| D.甲烷燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |

下列事实不能用电化学理论解释的是( )
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.铝片不用特殊方法保存 |
| D.锌跟稀硫酸反应时,滴入少量硫酸铜溶液后,反应速率加快 |
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,B极表面有大量气泡产生;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D经导线流向C;③A、C相连后,同时浸入稀H2SO4溶液中,H+向C极迁移;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺 序是 ( )
序是 ( )
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
某原电池总反应离子方程式为Mg + 2H + = Mg2++H2↑能实现该反应的原电池是
+ = Mg2++H2↑能实现该反应的原电池是
| A.正极为铜,负极为镁,电解质溶液为稀盐酸 |
| B.正极为铜,负极为铁,电解质溶液为稀硫酸 |
| C.正极为石墨,负极为镁,电解质溶液为CuSO4溶液 |
D. 正极为银,负极为镁,电解质溶液为NaCl溶液 正极为银,负极为镁,电解质溶液为NaCl溶液 |
下列变化是因为原电池反应而引起的是
| A.在空气中金属铝表面迅速氧化形成保护膜 |
| B.常温下,铁被浓硫酸“钝化”形成保护膜 |
| C.在潮湿的空气中钢铁易生锈 |
| D.在潮湿的空气中过氧化钠易变质 |
试题篮
()