有关下图装置中的叙述正确的是
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色 |
| C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH- |
D.Fe为阳极,其电极反应 为:Fe-2e-+2OH-=2Fe(OH)2 为:Fe-2e-+2OH-=2Fe(OH)2 |
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。)
依据记录数据判断,下列结论中正确的是
| A.金属乙能从硫酸铜溶液中置换出铜 |
| B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 |
| C.在四种金属中乙的还原性最强 |
| D.甲、丁若形成原电池时,甲为正极 |
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是表中的
| |
a极板 |
b极板 |
X电极 |
Z溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
 CuCl2 CuCl2 |
依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。下列说法不正确的是
| A.电极X的材料是铜 |
| B.电解质溶液Y是硝酸银溶液; |
| C.银电极为电池的正极,发生的电极反应为:Ag+ + e- ="=" Ag |
| D.盐桥中的阳离子向硫酸铜溶液中运动 |
下图为一原电池装置,下列叙 述中正确的是
述中正确的是
| A.铜离子在铜片表面被还原 |
| B.盐桥中的K+移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜是阳极,铜片上有气泡产生 |
关于如图所示装置的叙述正确的是
| A.电流由锌经导线流向铂,电子由铜经导线流向碳棒 |
| B.碳棒是正极,铜片是阳极 |
| C.锌片的质量逐渐减少,铂片的质量逐渐增加 |
| D.锌片上发生还原反应,碳棒上发生氧化反应 |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上 发生氧化反应 发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
下列关于铜锌稀H2SO4构成的原电池的有关叙述错误的是
| A.锌为负极,锌发生氧化反应 |
| B.铜为正极,但铜不发生反应 |
| C.负极发生还原反应,正极发生氧化反应 |
| D.外电路电子流入的一极为正极,电子流出的一极为负极 |
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:C2H5OH +3O2= 2CO2 +3H2O,电池示意图如下图。下面对这种电池的说法正确的是
| A.b极为电池的负极 |
| B.电池工作时电子由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:4H+ +O2+4e-=2H2O |
| D.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移 |
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是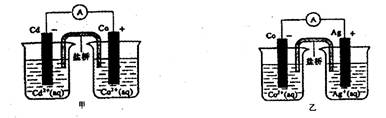
A.甲图电池反应的离子方程式为: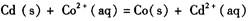 |
B. 反应能够发生 反应能够发生 |
| C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性 |
D.乙图当有Imol电子通过外电路时,正极有108克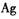 析出 析出 |
下列关于原电池的叙述中,错误的是
| A.用导线连接的两种不同金属同时插入液体中,就能形成原电池 |
| B.原电池是将化学能转化为电能的装置 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.在原电池中,电子流入的一极是正极,发生还原反应 |
美国加州Miramal海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2 2H2O,负极反应为:H2+CO32-→H2O+CO2+2e-。
则下列推断中,正确的是
| A.正极反应为4OH—→2H2O+O2+4e-↑ |
| B.当电池生成1mol水时,转移4mol电子 |
| C.放电时CO32-向负极移动 |
| D.放电时电子向负极移动 |
试题篮
()