下列叙述正确的是 ( )
| A.在pH=1的溶液中Na+、NH4+、[Al(OH)4]-、SO42-可以大量共存 |
| B.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA,NA为阿伏加德罗常数 |
| C.在铁制管道上连接一锌块利用了牺牲阳极保护法 |
| D.生活中可以使用明矾对饮用水进行杀菌消毒 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是()
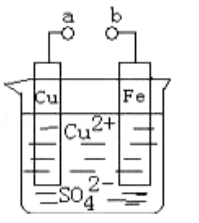
| A. | a和b不连接时,铁片上会有金属铜析出 |
| B. | a和b用导线连接时,铜片上发生的反应为: |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D. | a和b分别连接直流电源正、负极,电压足够大时, 向铜电极移动 |
结合下图判断,下列叙述正确的是( )
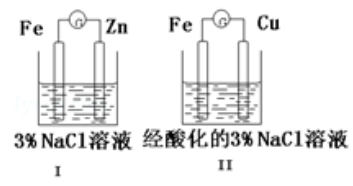
| A. | Ⅰ和Ⅱ种正极均被保护 |
| B. | Ⅰ和Ⅱ中负极反应均是 |
| C. | Ⅰ和Ⅱ中正极反应均是 |
| D. | Ⅰ和Ⅱ中分别加入少量 溶液,均有蓝色沉淀 |
以和
混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A. | 未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B. | 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C. | 电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D. | 镀锌层破损后对铁制品失去保护作用 |
下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是
| A.Zn | H2SO4(稀) | C | B.Cu | 酒精 | Ag |
| C.Zn | CCl4 | Cu | D.Fe | H2SO4(稀) | Fe |
下面能够构成原电池及电极反应式正确的是
| A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e-==Fe2+ |
| B.Al、Cu、稀硫酸,负极反应式为:Cu-2e-==Cu2+ |
| C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e-==AlO2-+2H2O |
| D.Zn、Cu、乙醇,负极反应式为:Zn-2e-==Zn2+ |
关于下列装置说法正确的是
| A.装置①中,盐桥中的K+ 移向CuSO4溶液 |
| B.装置②在电解开始阶段,b极附近溶液的pH增大 |
| C.可以用装置③在铜上镀银,c极为铜 |
| D.装置④中一段时间后会有Fe(OH)2生成 |
下列关于铜、锌和稀硫酸构成的原电池说法正确的是
| A.锌是正极,铜是负极 | B.电子经导线有锌流向铜 |
| C.电流沿导线有锌流向铜 | D.H+在溶液中向锌片移动 |
关于下图装置的叙述,错误的是
| A.铜是正极,其质量不变 |
| B.氢离子在铜表面被氧化,产生气泡 |
| C.电流从铜片经导线流向锌片 |
| D.电子从锌片经导线流向铜片 |
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示。下列说法不正确的是
| A.电流方向为:铝质易拉罐→导线→扬声器→导线→炭棒 |
| B.铝质易拉罐将逐渐被腐蚀 |
| C.电池总反应为:4Al+3O2+6H2O=4Al(OH)3 |
| D.炭棒上发生的主要反应为:O2+4e-+2H2O=4OH- |
X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
试题篮
()