关于下列各装置图的叙述不正确的是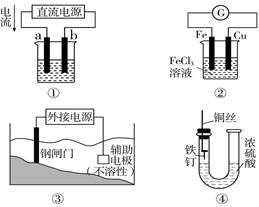
| A.用装置①精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉浸入浓硫酸中几乎没被腐蚀 |
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
| A. |
|
| B. |
|
| C. |
|
| D. |
|
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
| C.图中a极为铝条、b极为锌片时,导线中会产生电流 |
| D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
某小组为研究原电池原理,设计如图装置,下列叙述正确的是
| A.若X为Fe,Y为Cu,铁为正极 |
| B.若X为Fe,Y为Cu,电子由铜片流向铁片 |
| C.若X为Fe,Y为C,碳棒上有红色固体析出 |
| D.若X为Cu,Y为Zn,锌片发生还原反应 |
下列关于原电池的叙述中,正确的是
| A.电极只能由两种不同的金属构成 |
| B.负极发生的电极反应是还原反应 |
| C.工作时其正极不断产生电子并经外电路流向负极 |
| D.能将化学能转变为电能 |
有a、b、c、d四种金属,将a与b用导线连结起来浸入某电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
| A.d、a、b、c | B.b、a、d、c | C.d、b、a、c | D.d、c、a、b |
铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是
| A.铜电极上发生还原反应 | B.锌电极是原电池的负极 |
| C.电子从铜极经过外电路流向锌极 | D.锌电极上的反应为Zn-2e— ="=" Zn2+ |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42—向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
| A.①②③ | B.③⑤⑦ | C.④⑤⑥ | D.②③④⑤⑦ |
气体的自动化检测中常常应用原电池原理的传感器,电池的工作原理如右图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。右下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是

| A.上述气体检测时,敏感电极均作电池正极 |
| B.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl- |
| C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH- |
| D.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上的电流大小相同 |
某原电池装置如右图,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,Y电极反应为Y-2e-=Y2+,可知X、Y、Z、W的还原性强弱顺序为
| A.X>Z>Y>W | B.Z>W>X>Y | C.Z>Y>X>W | D.Z>X>Y>W |
如图将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是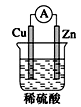
| A.溶液的pH增大 | B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42-浓度增大 | D.溶液的密度增大 |
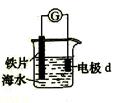
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是
| A.电池工作时,电子由铝板沿导线流向铂网 |
| B.铂电极做成网状,可增大与氧气的接触面积 |
| C.正极反应为:O2+H2O+2e-=2OH- |
| D.该电池通常只需要更换铝板就可继续使用 |
试题篮
()