根据下图,判断下列说法中错误的是( )
| A.导线上电子由Ag极流向石墨极 |
| B.负极电极反应式:Fe3+ + e-=Fe2+ |
| C.盐桥中阴离子移向AgNO3溶液 |
| D.总反应为:Fe3+ + Ag=Fe2+ + Ag+ |
某原电池总反应离子方程式为:2Fe3+ +Fe == 3 Fe2+,能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 |
| B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是
| A.电流从铜片经导线流向锌片 |
| B.该装置将电能转变为化学能 |
| C.一段时间后,铜片质量减轻 |
| D.锌片发生还原反应 |
一个原电池的总反应的离子方程式是Zn + Cu2+= Zn2+ + Cu,该反应的原电池的组成正确的是
| |
A |
B |
C |
D |
| 正极 |
Zn |
Ag |
Cu |
Cu |
| 负极 |
Cu |
Cu |
Zn |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
FeCl2 |
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
将锌片和铜片用导线连接后平行放入稀硫酸中,发生原电池反应,下列叙述错误的是
| A.溶液的pH增大 |
| B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42— 浓度增大 |
| D.溶液的密度增大 |
下列叙述正确的是 ( )
| A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
右图为一原电池的结构示意图,下列说法中,错误的是 
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )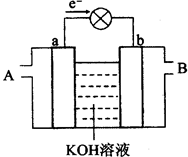
| A.A处通入空气,B处通入水煤气 |
| B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C.a电极发生还原反应,b电极发生氧化反应 |
| D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L |
在理论上不能用于设计原电池的化学反应是
| A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s) △H<0 |
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2O(l) △H<0 2CO2(g)+3H2O(l) △H<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0 |
| D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) △H<0 |
原电池是将化学能直接转化为电能的装置,原电池反应的本质是
| A.化合价的升降 | B.离子定向移动 |
| C.氧化还原反应 | D.电能的储存 |
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如图1处理方法回收废电池中的各种资源.
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2.
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
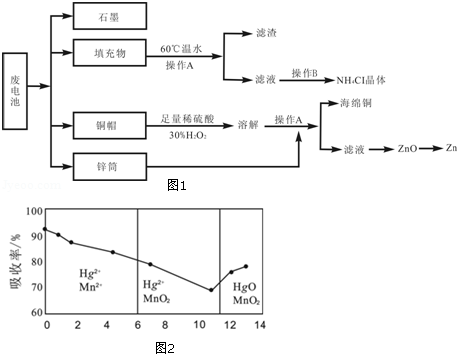
根据图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 .
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
试题篮
()