【改编】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知: 3I2+6OH—==IO3—+5I—+3H2O,下列说法正确的是
| A.右侧发生的电极方程式: 4OH— -4e— =2O2 ↑+ 2H2O |
| B.电解结束时,右侧溶液中不含有IO3— |
| C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑ |
| D.左侧为阳极,右侧为阴极,电子由右侧Pt电极通过电源流向左侧Pt电极上 |
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是
| A.c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
| B.A溶液为硫酸,B溶液为氢氧化钠 |
| C.a气体为氢气,b气体为氧气 |
D.该电解反应的总方程式为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑ 2H2SO4+4NaOH+O2↑+2H2↑ |
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,a电极的电极反应式为4OH--4e-===O2↑+2H2O |
| D.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
| A.该装置工作时,光能和电能全部转化为化学能 |
| B.该装置工作时,H+向b极板移动 |
C.反应 ,每消耗1 mol CO2转移4 mol电子 ,每消耗1 mol CO2转移4 mol电子 |
| D.电极a上CO2参与的电极反应为:3CO2+ 18H+ + 18e-= C3H8O +5H2O |
下列离子方程式正确的是
| A.电解氯化镁溶液:2Cl-¯+ 2H2O ═ 2OH¯- + H2↑+ Cl2↑ |
| B.将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
| C.将少量CO2气体通入苯酚钠溶液中:2C6H5O- + CO2 + H2O→2C6H5OH +CO32- |
| D.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O |
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e﹣=4OH﹣ |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
右图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是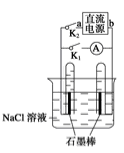
| A.若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为正极,b为负极 |
| B.关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则 a为负极,b为正极 |
| C.若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒 |
| D.若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,左侧产生的是氢气,右侧产生的是氯气,再关闭K1,打开K2,构成原电池,则左侧是正极,右侧是负极,在左侧石墨棒上发生还原反应,发生的电极反应为H2-2e-+2OH-=2H2O,正确。 |
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN--2e—+2OH-=CNO—+H2O
②2Cl--2e═=Cl2↑
③3Cl2 +2CNO-+8OH-=N2+6Cl-+2CO32-+4H2O
下列说法不正确的是
| A.a是电源的正极 |
| B.铁电极上发生的电极反应式为2H++2e—=H2↑ |
| C.为了使电解池连续工作,需要不断补充NaOH |
| D.除去1molCN-,电解过程中共产生标准状况下11.2L气体 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
则下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间,向乙池加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
能正确表示下列反应的离子方程式的是
A.用惰性电极电解MgCl2 溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-= CaCO3↓+CO32-+2H2O |
| C.过氧化钠与水反应:2O22-+ 2H2O= 4OH-+O2↑ |
| D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时: |
2Ba2++4OH-+Al3++2SO42-= 2BaSO4↓+AlO2-+2H2O
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体 积(标准状况)。则下列说法不正确的是
| A.电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B.b电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑ |
| C.曲线O~P段表示O2的体积变化 |
| D.从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol |
下列有关离子方程式与所述事实相符且正确的是
A.用惰性电极电解CuCl2溶液2Cu2+2H2O 4H++O2↑+2Cu 4H++O2↑+2Cu |
B.Ba(OH)2溶液中滴加NaHSO4溶液至中性 |
C.漂白粉溶液在空气中失效 |
D.用氯化铁溶液和沸水反应制取氢氧化铁胶体 |
以H2O2、熔融盐Na2CO3组成的燃料电池来电解制备N2O5,装置如下图所示,其中Y为CO2。下列说法错误的是
| A.石墨Ⅱ电极上发生反应的电极反应式为:O2+4e一十2CO2=2CO32- |
| B.在电解池中生成N2O5的电极反应式为:N2O4+2NO3一-2e一=2N2O5 |
| C.放电时熔融盐中CO32-向石墨I电极方向移动 |
| D.每消耗11.2 L(标准状况)氢气,理论上可以制得108 g N2O5 |
试题篮
()