按如图所示装置进行下列不同的操作,其中不正确的是
| A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 |
| B.只接通K1,一段时间后,U形管中出现白色沉淀 |
| C.只接通K2,U形管左、右两端液面均下降 |
| D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-==IO3-+5I-+3H2O,下列说法不正确的是 ( )

| A.电源右侧为负极 |
| B.右侧发生的电极方程式:2H++2e-==H2↑ |
| C.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 通电 |
| D.电解槽内发生反应的总化学方程式KI+3H2O===KIO3+3H2↑ |
可充电电池因其可以反复使用而深受广大消费者喜爱。请你根据对可充电电池的理解,选出下列有关说法正确的是 ( )
| A.放电时,正极发生氧化反应 | B.放电时,把热能转化为电能 |
| C.充电时,电池的负极发生还原反应 | D.充电时,把化学能转化为电能 |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O 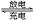 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A.放电时负极反应为:3Zn — 6e-+6OH- ="=" 3Zn(OH)2 |
| B.放电时OH-向正极移动 |
| C.充电时每转移3 mol电子,阳极有1 mol Fe(OH)3 被还原 |
| D.充电时阳极反应式为:3Zn(OH)2+6e- ="=" 3Zn+6OH- |
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl-+ 2OH--2e-= ClO-+ H2O[ |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
下图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池是________(填“原电池”“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________ ____。
(4)乙池中反应的化学方程式为_____ ___,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________。
| A.MgSO4 | B.CuSO4 | C.Pb(NO3)2 | D.AgNO3 |
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2。下列叙述正确的是
2Ni(OH)2。下列叙述正确的是
| A.电池放电时,电池负极周围溶液的pH不断增大 |
| B.电解质溶液可以是稀硫酸 |
| C.外电路中每通过0.2mol电子,H2的质量理论上减小0.2g |
| D.电池工作时,电子由正极通过外电路流向负极 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2(SO4)3 |
| D. |
CuSO4 |
AgNO3 |
500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)="6.0" mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况)。下列说法正确的是
| A.原混合溶液中c(K+)为3mol/L |
| B.上述电解过程中共转移4 mol电子 |
| C.电解得到的Cu的物质的量为0.5mol |
| D.电解后溶液上c(H+)为4 mol/L |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一小段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗560 mL(标准状况下)O2,此时丙池中理论上最多产生2.9g固体 |
下表为部分短周期元素的原子半径及主要化合价。下列说法正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.186 |
0.143 |
0.104 |
0.075 |
0.066 |
| 主要化合价 |
+1 |
+3 |
+6、-2 |
+5、-3 |
-2 |
A.气态氢化物的稳定性:R>T
B.工业上电解MCl3溶液制备单质M
C.化合物L2T与QT2所含化学键类型相同
D.L与Q的最高价氧化物对应水化物均能与M(OH)3反应
电浮选凝聚法处理酸性污水的工作原理如图。下列说法不正确的是
| A.铁电极的电极反应式为:Fe—2e—=Fe2+ |
| B.通入甲烷的石墨电极的电极反应式为:CH4+4CO32——8e—=5CO2+2H2O |
| C.为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D.若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
用电解法制备无机高分子聚合物——聚合氯化铝。如图所示,在一定条件下进行,电解总反应可表示:Al+H2O+AlCl3 [Al2(OH)mClx-m]n+H2↑(未配平),则下面说法中正确的是
[Al2(OH)mClx-m]n+H2↑(未配平),则下面说法中正确的是

| A.Cu电极与电源正极相连 |
| B.聚合氯化铝化学式中x=4 |
| C.电解时阴极的电极反应式为:2H++2e¯=H2↑ |
| D.将电源换成导线连接两电极,则不能形成原电池 |
试题篮
()