用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
| A.b电极上的主反应是:SO32--2e-+H2O==SO42-+2H+ |
| B.若D是混合气体,则可能含有SO2、O2等成分 |
| C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 |
| D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
铝和氢氧化钾都是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示,下列说法正确的( )


| A.阳极产生KOH |
| B.阴极产生KOH |
| C.大量H+通过离子交换膜从左侧到右侧 |
| D.大量K+通过离子交换膜从右侧到左侧 |
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水。乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是
| A.电解过程中,阴极附近的乙醛被氧化 |
| B.阳极反应CH3CHO-2e-+ H2O ="==" CH3COOH +2H+ |
| C.若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 |
| D.现处理含1mol乙醛的废水,至少需转移1mol电子 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是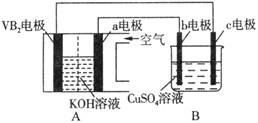
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅。(已知:3I2+ 6OH—= IO3—+5I—+3H2O , IO3—离子无色) ;下列说法不正确的是
| A.右侧发生的电极反应式:2H2O+2e—= H2↑+2OH- |
| B.a为电源正极 |
| C.电解结束时,右侧溶液中没有IO3— |
D.用阴离子交换膜,电解槽内发生的总化学方程式为:KI + 3H2O  KIO3+3H2↑ KIO3+3H2↑ |
观察下列几个装置示意图,有关叙述正确的是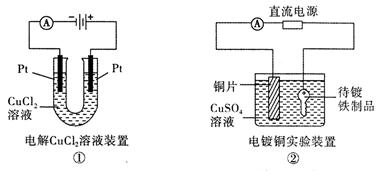
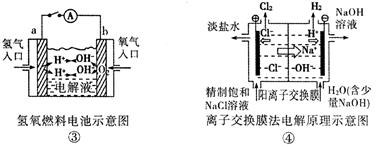
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是
| A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 |
B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是 |
| C.闭合K,断开K2,电流从石墨电极经过K.流向铁电极 |
| D.闭合K,断开K2,左侧烧杯中的溶液pH将逐渐降低 |
在如图装置中,通电一段时间后,乙装置左侧电极质量增加,下列说法不正确
| A.向甲中通入适量的HCl气体,可使溶液恢复到电解前状态 |
| B.电解过程中丙中溶液的pH无变化 |
| C.乙中左侧电极质量增加是因为有铜在此电极析出 |
| D.当甲装置中共产生标准状况下0.448 L气体时,丙中Cu电极上质量增加4.32 g |
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐降低 |
| C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 |
| D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体 |
甲、乙两个电解池均以Pt为电极,且互相串联。甲池盛有CuSO4溶液,乙池中盛有一定量的某盐溶液。通电一段时间后,测得甲池电极质量增加0.64g,乙池电极上析出0.24 g金属,则乙池中的溶质可能是
| A.MgSO4 | B.Al(NO3)3 | C.CuSO4 | D.Na2SO4 |
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
| A.b电极上的主反应是 SO32--2e-+H2O===SO42-+2H+ |
| B.若D是混合气体,则可能含有SO2、O2等成分 |
| C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 |
| D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
如图所示,将纯铁棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是
| A.去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 |
| B.M连接电源正极,N连接电源负极,则Fe棒被保护不会溶解 |
| C.M连接电源负极,N连接电源正极,当两极产生气体总量为22.4 mL(标准状况)时,则生成0.001 mol NaOH |
| D.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:

⑴电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为 。
⑵净化步骤所得滤饼的主要成分是 。回收的洗涤液代替水配制电解液,目的是回收利用其中的 。
⑶溶液I的主要成分是 。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 。
⑷将Co2O3还原成Co粉的化学反应方程式为 。
试题篮
()