用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是
A.Cu Cu(NO3)2 Cu(NO3)2 |
B.Cu Cu(NO3)2 Cu(NO3)2 |
C.Cu CuCl2 CuCl2 Cu(NO3)2 Cu(NO3)2 |
D.Cu CuO CuO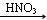 Cu(NO3)2 Cu(NO3)2 |
下列实验操作都可能引起实验误差,其中说法正确的是( )
| A.常温下测定的气体摩尔体积大于22.4 L·mol-1 |
| B.100 mL 0.1 mol·L-1NaOH溶液和100 mL 0.1mol·L-1CH3COOH溶液反应放出的热量等于573 J |
| C.配制1.0 mol·L-1NaCl溶液定容时仰视容量瓶的刻度线导致所配溶液浓度偏高 |
| D.中和滴定时,锥形瓶含有水就注入待测液,所测待测液浓度减小 |
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列正确的是
| A.盐酸的物质的量浓度为1 mol/L |
| B.P点时反应恰好完全,溶液呈中性 |
| C.曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D.酚酞不能作本实验的指示剂 |
右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与试验事实不相符的是
| A.SO2 (NaOH溶液)无色喷泉 | B.NH3(H2O含酚酞)红色喷泉 |
| C.NO(H2O含石蕊)红色喷泉 | D.HCl(AgNO3溶液)白色喷泉 |
查阅资料发现,金属钠不仅能与氧气和水反应,还能与很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精、金属钠和水反应的异同点,下列的研究方法中用不到的是( )
| A.观察法 | B.分类法 | C.实验法 | D.比较法 |
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是 ( )
| A.镁粉只直接与溴水中的溴反应 | B.镁粉在水的催化下与溴发生反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 | D.镁粉只与溴水中的酸反应 |
下列与实验相关的叙述中,正确的是
A.加热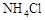 晶体时,将湿润的红色石蕊试纸靠近试管口,检验 晶体时,将湿润的红色石蕊试纸靠近试管口,检验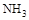 的生成 的生成 |
B.向某溶液中加入足量盐酸酸化,无现象,再加人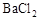 溶液,有白色沉淀生成,说明原溶液中存在 溶液,有白色沉淀生成,说明原溶液中存在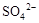 |
| C.酸碱中和滴定实验中用到的玻璃仪器仅有酸式滴定管、碱式滴定管和烧杯 |
D.用量筒量取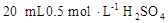 溶液于烧杯中,加水80mL,,配制成0.1 溶液于烧杯中,加水80mL,,配制成0.1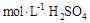 溶液 溶液 |
用氯气消毒过的自来水配制下列溶液时,会使所配的溶液的溶质发生变化的是( )
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤KI
| A.只有①② | B.只有①④⑤ | C.只有②④⑤ | D.①②③④⑤ |
某探究小组用洗净的废铜屑制备硝酸铜,下列方案中既节约原料又环保的是
| A.Cu+HNO3(浓)→Cu(NO3)2 |
| B.Cu+HNO3(稀)→Cu(NO3)2 |
C.Cu CuO CuO Cu(NO3)2 Cu(NO3)2 |
D.Cu  CuSO4 CuSO4 Cu(NO3)2 Cu(NO3)2 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
| A.3-4-1-2 | B.1-2-4-3 | C.4-2-3-1 | D.3-4-2-1 |
配制一定溶质物质的量浓度的KOH溶液时,造成实验结果偏低的原因可能是( )
| A.容量瓶中有少量水 |
| B.有少量KOH残留在烧杯中 |
| C.定容时俯视 |
| D.定容时仰视 |
设NA表示阿伏加德罗常数,下列关于0.2 mol·L-1的BaCl2溶液中说法不正确的是( )
| A.2 L溶液中Ba2+和Cl-的总数为0.8NA |
| B.500 mL溶液中Cl-的浓度为0.2 mol·L-1 |
| C.500 mL溶液中Ba2+的浓度为0.2 mol·L-1 |
| D.500 mL溶液中Cl-的总数为0.2NA |
某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
| A.②→④→①→③→⑤ | B.②→①→③→④→⑤ |
| C.③→①→②→⑤→④ | D.①→③→⑤→②→④ |
下列实验可达到实验目的的是:
①将 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
② 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备
③向CH3CH2Br中滴入AgNO3溶液以检验溴元素
④用溴水即可检验CH2=CH-CHO中的碳碳双键
| A.只有① | B.只有①④ | C.只有①③④ | D.都不能 |
试题篮
()