为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
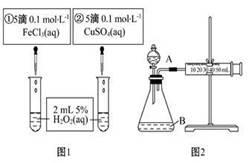
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
下列实验不能获得成功的是
| |
实验目的 |
实验步骤 |
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
探究蔗糖水解的产物中是否含有葡萄糖 |
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
下列实验不能获得成功的是
| |
实验目的 |
实验步骤 |
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
除去甲烷中混有的乙烯 |
把混合气体通入酸性高锰酸钾溶液 |
用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①加水,观察颜色 |
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是()
| 选项 |
实验及现象 |
结论 |
| A |
将湿润的红色石蕊试纸放在试管口,试纸变蓝 |
反应中有 |
| B |
收集产生的气体并点燃,火焰呈淡蓝色 |
反应中有 |
| C |
收集气体的同时测得溶液的pH为8.0 |
弱碱性溶液中 |
| D |
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 |
弱碱性溶液中 |
在探究SO2水溶液成分和性质的实验中,下列根据实验现象得出的结论正确的是
| A.向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性 |
| B.向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42— |
| C.将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 |
| D.向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |
某化学兴趣小组为了探究铬和铁的活泼性,设计如图所示装置,下列推断合理的是
| A.若铬比铁活泼,则电子经外电路由铁电极流向铬电极 |
| B.若铬比铁活泼,则铁电极反应式为2H++2e-=H2↑ |
| C.若铁比铬活泼,则溶液中H+向铁电极迁移 |
| D.若铁电极附近溶液pH增大,则铁比铬活泼 |
实验:①0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合得到浊液,过滤。
②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清。
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解。
下列分析不正确的是
| A.实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl¯ |
| B.实验②证明了该温度下Ag2S比Ag2SO4更难溶解 |
| C.实验③的溶液中含有Ag(NH3)2+微粒 |
| D.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
实验室制备氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2 H2O反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学设计了4组实验方案(每次均量取20 mL反应残余液进行实验),其中正确的是
MnCl2+ Cl2↑+2 H2O反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学设计了4组实验方案(每次均量取20 mL反应残余液进行实验),其中正确的是
| A.与足量AgNO3溶液反应,过滤、洗涤、干燥,称量生成的沉淀质量为a g |
| B.稀释10倍后取20 mL用已知浓度的NaOH溶液滴定,消耗NaOH的体积为b mL |
| C.与足量NaHCO3固体反应,逸出气体用足量碱石灰吸收,增重c g |
| D.加入d1g CaCO3(过量)充分反应后,称量剩余固体质量为d2 g[已知:Ksp( CaCO3)>Ksp( MnCO3)] |
试题篮
()