实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放_______________ ,目的是__________________。
(2)反应中加入过量乙醇的目的是 ________________________ 。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是
_______________________________________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作流程图。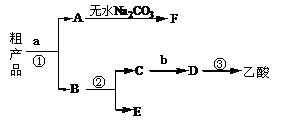
请回答:
试剂a是________,试剂b是___________
分离方法①是 __________________
分离方法②是 __________________
分离方法③是 ___________________
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(3)“烧杯B”这种加热方式的优点是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为
____________________________________________ _____________________。
如图在试管甲中先加入2mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验。试回答:
(1)该实验中长导管的作用是 ,其不宜伸入试管乙的溶液中,原因是 。
(2)试管乙中饱和Na2CO3的作用是①除去乙酸乙酯中的乙醇和乙酸,②
(3)试管乙中观察到的现象是 。
(4)试管甲中加入浓硫酸的目的是 ①催化剂,吸水剂②
(5)液体混合加热时液体体积不能超过试管容积的 ,本实验反应开始时用小火加热的原是 ;(填字母)A.加快反应速率B. 防止了反应物未来得及反应而挥发损失(已知乙酸乙酯的沸 点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
甲、乙、丙三位同学,分别在相同条件下用乙酸与乙醇反应来制取乙酸乙酯,但未用饱和Na2CO3溶液来吸收。
(1)甲、乙、丙同学将得到的酯提纯,在未用指示剂的情况下,他们都先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来。但得到的结果却不同:①甲得到了不溶于水的中性酯;②乙得到显酸性的酯;③丙得到大量水溶性物质。试分析产生上述各种现象的原因。
(2)丁同学为了进一步找出原因,将所得产物进行了分离探究,他的实验操作步骤流程
如下图。请你帮他完成该实验并填写下列空白。
分离出的物质名称:A ,B ,C ,D ,E ;
选择的试剂:a ,b ;
分离物质的方法:① ,② ,③ 。
(18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。


①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
②试管a中加入碎瓷片的作用是 ,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填序号)。
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
③实验中加热试管a的目的是:(i) ;(ii) 。
④试管b中盛有饱和Na2CO3溶液,其作用是 。
⑤反应结束后,振荡试管b,静置。观察到的现象是 。
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是 。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式: 。
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为 。
②实验中观察到e内有红棕色气体出现,证明氨气具有 性,e中发生反应的化学方程式为 。
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。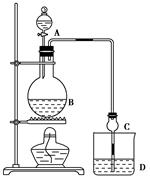
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/ ℃ |
34.7 |
78.5 |
118 |
77.1 |
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是 ;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: 。
球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 。
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
(1)A的结构式为____________,B中决定性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①______________________,反应类型:____________。
②_____________________________,反应类型:____________。
(3)实验室怎样鉴别B和D?________________。
(4)在实验室里我们可以用如图所示的装置来制取F,乙中所盛的试剂为____________,该溶液的主要作用是____________________;
该装置图中有一个明显的错误是______________________________。
葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖) 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
实验室用下图所示装置来制取乙酸乙酯,回答下列问题:
(1)请写出本实验中发生的主要反应方程式 。
(2)配置混合溶液时,加入试剂的正确顺序是 (填“A”或“B”)。
A.先加乙醇,再慢慢注入浓硫酸和乙酸 B.先加浓硫酸,再慢慢注入乙醇和乙酸
(3)浓硫酸的作用是 。
(4)饱和Na2CO3溶液的作用是 。
(5)实验完成后,右边试管液面上有透明的不溶于水的油状液体生成。若要分离10mL该液体混合物需要用到的主要玻璃仪器是 ,这种分离方法叫做 。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
⑴装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑵该反应属于哪类反应类型 。
| A.加成反应 | B.取代反应 | C.水解反应 | D.酯化反应 |
⑶反应中浓硫酸的作用是:
⑷写出制取乙酸乙酯的化学反应方程式:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、铜粉,试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全。有关物质的沸点如下:
| 物质 |
乙醛 |
乙酸 |
甘油 |
水 |
| 沸点/℃ |
20.8 |
117.9 |
290 |
100 |

请完成下列问题:
(1)试管A在60℃~80℃时发生的主要反应的化学方程式为(根据题意注明反应条件)
______________________________________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内主要反应完成后,温度计水银球的位置应在_____________,目的是____________________________。
(3)烧杯B内盛装甘油,甘油浴的作用是:
_____________________________________,______________________________________。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。该方案为(简述操作过程):__________________________________________________
(12分)乙二酸(HOOC-COOH)俗称草酸,该酸广泛存在于多种植物的细胞膜内,其晶体通常含有结晶水(H2C2O4·2H2O),晶体的熔点为101.5℃,无水草酸的熔点为189.5℃。草酸易升华,其在157℃时大量升华,并开始分解,分解产物为CO、CO2、H2O。
某研究性学习小组的同学决定对草酸的分解反应进行探究,设计出如下实验验证乙二酸的分解并测定其分解率,操作步骤如下:
①先把乙二酸晶体放在烘箱中进行烘烤,去掉结晶水,备用。
②按图2连接好装置。
③检查装置的气密性。
④打开活塞a,通入H2一会儿,再关闭a;点然酒精灯b、c。
⑤当C装置中固体消失后,停止加热
⑥打开活塞a,继续通入H2,直至冷却。
试回答下列问题:
⑴检验该套装置的气密性的方法是____________________________________________。
⑵装置A的作用______________________________,B的作用_____________________;
装置E的作用_____________________________。
⑶若分解结束后,不再通入氢气,会使所测的乙二酸的分解率_________(填“增大”、“减小”或“不变”)。
⑷若称取H2C2O4(烘干)的质量为4.5g,实验结束后,称得D、E、F分别增重0.95g、0.40g、1.98g,则乙二酸的分解率为_______________。[
(14分)某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO(图中夹持装置已略去)。(已知草酸钙难溶于水,草酸沸点150℃)
(1)装置C的作用是______________________,装置E的作用是 _____________________
(2)乙二酸受热分解的反应方程式是
(3)①证明分解产物中有CO2的现象是
②证明分解产物中有CO的现象是
(4)该装置有不足之处,请写出弥补不足之处的理由和具体方法:

(3分)乙酸是食醋的主要成分,它具有以下化学性质:‘
(1)可使紫色石蕊试液变______色,说明乙酸具有______性。
(2)能发生酯化反应。实验室用右图所示装置制取乙酸乙酯,请写出该反应的化学方程式: 。
试题篮
()