0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(提示:同一个C原子连两个羟基是不稳定结构)通过计算解决以下两个问题,要有必要计算过程:
(1)试推断该有机物的分子式。
(2)若0.2 mol该有机物恰好能与9.2 g金属钠完全反应,试确定该有机物的结构简式。
乙醇、乙酸都是有机化工重要的基础原料。
(1).空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为 。
(2).浓硫酸催化下,乙酸和乙醇生成乙酸乙酯

某化学兴趣小组的同学用以下装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是 。
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止 。
③相关物质的部分性质:
| |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点 |
78.0℃ |
117.9℃ |
77.5℃ |
| 水溶性 |
易溶 |
易溶 |
难溶 |
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由: 。④分离小试管中的乙酸乙酯应使用的仪器名称是 ;
⑤分离时,乙酸乙酯应该从仪器 (填“下口放” 或“上口倒出”)。
⑥兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如下表:
| 实验序号 |
乙醇(mL) |
乙酸(mL) |
乙酸乙酯(mL) |
| a |
2 |
2 |
1.33 |
| b |
3 |
2 |
1.57 |
| c |
4 |
2 |
X |
| d |
5 |
2 |
1.76 |
| e |
2 |
3 |
1.55 |
表中数据X的范围是 ;实验a与实验e探究的目的是 。
某种饱和一元醇0.3 g,与足量的钠起反应后,在标准状况下生成56 mL氢气。求这种一元醇的相对分子质量及分子式,并写出该一元醇可能有的各种结构式。
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
 请根据上述信息回答:
请根据上述信息回答:
请回答下列问题: (1)H中含氧官能团的名称是 。B→I的反应类型为 。
(1)H中含氧官能团的名称是 。B→I的反应类型为 。 (2)只用一种试剂鉴别D、E、H,该试剂是 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。 (3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。 (4)D和F反应生成X的化学方程式为 。
(4)D和F反应生成X的化学方程式为 。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。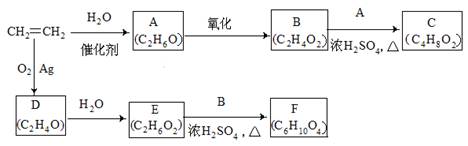
请回答下列问题:
(1)A的化学名称是 。
(2)B和A反应生成C的化学方程式为 ,该反应的类型为 。
(3)D为环状化合物,其结构简式为 。
(4)F的结构简式为 。
(5)D的同分异构体的结构简式为 。
今有化合物:
(1)请写出丙中含氧官能团的名称: 。
(2)请判别上述哪些化合物互为同分异构体: 。
(3)鉴别乙的方法(指明所选试剂及主要现象即可): 。
(4)请按酸性由强至弱排列甲、乙、丙的顺序: 。
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知: R1-CH=CH-R2 R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)A分子中若有一个氢原子被溴原子取代,则取代产物有 种。F的名称是 ,C中含有的官能团的名称是 。
(2)③的反应条件是 。
(3)写出下列反应类型:⑥ ,⑨ 。
(4)有机物B和I的关系为 (填序号,多填扣分)。
| A.同系物 | B.同分异构体 | C.都属于醇类 | D.都属于烃 |
(5)写出反应⑩的化学方程式: 。
松油醇是一种调香香精,是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(18O是氧原子的一种同位素)经下列反应制得:
(1)α-松油醇的分子式为 。
(2)写出α-松油醇中官能团的名称 。
(3)α-松油醇能发生反应的类型有 。
| A.加成反应 | B.消去反应 | C.氧化反应 | D.取代反应 |
(4)物质M是A的一种同分异构体,写出该物质在Cu作催化剂的条件下和氧气反应的化学方程式 。
(5)写出下列物质的结构简式:β-松油醇 。
LiAlH4由Li+、A1H4一构成,是有机合成中常用的还原剂。
(1)Al元素在周期表的位置是第__________周期__________族。
(2)比较离子半径大小:Li+__________ H一(选填“>"、“<”或“=”)。
(3)LiAlH4中含有的化学键类型为____________________________________。
(4)LiAlH4中氢元素的化合价为__________,它与水反应生成的单质气体为__________。
(5)LiCl溶液显酸性,用离子方程式说明原因____________________________________。
(6)如图所示,已知75%A的水溶液常用于医疗消毒,则A的结构简式为__________;CH3COOH与A在浓硫酸催化下生成B的有机反应类型为__________。
依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是 -羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)
-羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)
(1)若使 全部变成乙醛,可采用的试剂是 或 。
全部变成乙醛,可采用的试剂是 或 。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
已知部分物质的性质:
苯甲醇:稍溶于水,易溶于有机溶剂;苯甲醛:微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.34g,易溶于有机溶剂。
主要过程如图所示:
回答下列问题:
(2)操作I的名称是______,乙醚溶液中所溶解的主要成分是____;
(3)操作Ⅲ的名称是______,产品乙是______。
(4)按上述操作所得的产品甲中常含有一定量的有机杂质 (填写杂质的名称),限用下 列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液。写出检验甲中含有该杂质的过程: 。
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.
请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。(已知—OH,—COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题: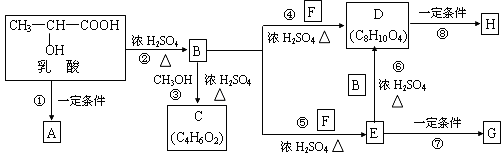
(1)推断C、F的结构简式。C: ;F: 。
(2)B中所含的官能团名称为 ;反应③的反应类型是 。
(3)反应①的化学方程式为 。
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________;B瓶溶液的作用是________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________;装置①中所盛的是________,作用是______________________。
(5)装置④中所盛的固体药品是________,它可以验证的产物是________。
(6)尾气应如何处理?_________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。
非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
(1)O2-的离子结构示意图为 ,CS2的晶体类型为 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是 ;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于 。
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式 。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: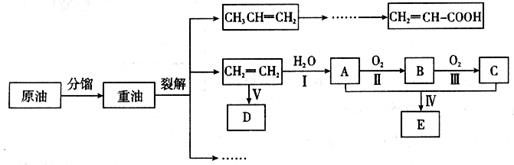
已知:
(1)写出A的电子式 。
(2)反应II的化学方程式是__________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(4)E是有香味的物质,在实验室用下图装置制取。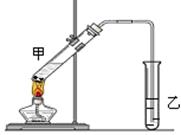
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是 。
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
试题篮
()