选做(12分)【化学——物质结构与性质】X、Y、Z为前四周期元素,且原子序数依次增大。X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子。请回答下列问题:
(1)X所在周期中第一电离能最大的主族元素是_______(填元素符号);H2X2分子中X原子的杂化方式是_______。
(2)Y与X可形成YX42-。
①YX42-的立体构型是_____________。
②写出一种与YX42-互为等电子体分子的化学式__________。
(3)Z的氯化物与氨水反应可形成配合物[Z(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为_________。
(4)Y与Z形成化合物晶体的晶胞如图所示。已知该晶体的密度为a g·cm-3,则该晶胞的体积为___________cm3(NA表示阿伏加德罗常数的值)。
氮元素可形成卤化物、叠氮化物及络合物等。
(1)在铜催化作用下F2和过量NH3反应得到NF3,其分子立体构型为_____________;NF3是_________键结合形成的___________分子(填极性或非极性)。固态NF3晶体熔点比冰______________(填高或低)。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子有: (举2例),由此可推知N3-的立体构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co(N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的电子排布式: ;[Co(N3)(NH3)5]SO4中钴的配位数为 ;配位原子结构特征是________;CN-的电子式是 。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如上图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性大 |
(4)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,该种异构体的结构可用示意图表示为 。
(5)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于醚、丙酮等有机溶剂。据此判断三氯化铁晶体类型为____________;
(6)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
下表是元素周期表的一部分,回答下列问题(答题时用具体元素符号表示)。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
|
|
| ⑥ |
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
| |
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
(1)①、③形成的6原子气态化合物中含 个σ键, 个π键。
(2)元素⑨的原子核外次外层电子数为 个。焊接钢轨时,常利用元素⑨的氧化物与⑦的单质在高温下发生反应,写出其中一种反应的化学方程式 。
(3)④、⑤两元素原子第一电离能较大的是 ,两元素以质量比7:12组成的化合物A是一种高效火箭推进剂,相对分子质量为152,A的分子式为 。
(4)⑥和⑧可形成某离子化合物,下图所示结构 (选填“能”或“不能”)表示该离子化合物的晶胞;下图所示结构中,X离子的堆积方式为 (选填“ABAB…”或“ABCABC…”)。
(5)元素⑩单质的晶胞如图所示,该晶胞中金属原子的配位数为 ,每个晶胞“实际”拥有的原子数是 。
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为 。
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为 ,离子的空间构型是 。
(3)液氨分子间存在自耦电离:2NH3 NH2-+NH4+,NH2-中氮原子轨道的杂化类型是 ,H+易与NH3形成NH4+,配位键的解释是 。
NH2-+NH4+,NH2-中氮原子轨道的杂化类型是 ,H+易与NH3形成NH4+,配位键的解释是 。
(4) 胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为 ,1mol CN-中含有的π键的数目为 。
选考(12分)【化学一物质结构与性质】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)镓的基态原子的电子排布式是__________________________。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为________(用元素符号表示)。
(3)气态SeO3分子的立体构型为____________________。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________________。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为________________;若该晶体的边长为a cm,则该合金密度为____________g·cm-3(阿伏加德罗常数的值为NA)。
【化学-选修3,物质结构与性质】X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大。X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素。Z元素形成的一种化合物常用作净水剂。W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl。请回答下列问题:
(1)XH3可作低温溶剂,它易液化的原因是 ,Y所在周期中第一电离能最大的主族元素是 。
(2)XY3-离子的立体构型是 ,其中心原子采取 杂化。
(3)W3+的核外电子排布式是 ,WCl3形成的六配位的配合物化学式为 。
(4)某种Z—Fe合金的晶胞如图所示,该合金的化学式为 。若晶胞的边长为a nm,则合金的密度为 g·cm-3。
[化学—选修3物质结构与性质】(巧分)已知A, B、C、D, E, F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:
(l)F元素的价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
④B2A2分子中的A-B键属于 键
键
(3)B,C,D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示) B、C、D三种元素中与BD2互为等电子体的分子式为 (用元素符号表示)
(4)A2E分子中心原子的杂化类型为_____。比较A2D与A2E分子的沸点,其中沸点较高的原因为 。元素D可形成两种同素异形体,其中在水中溶解度更大的是 (填分子式)。
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式I与方式II中F原子配位数之比为 ,晶体密度之比为 。
(化学一物质结构与性质,13分)铜及其化合物在现代生活中应用广泛。
(1)用黄铜矿炼铜的最后一步反应为: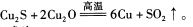
①硫元素的基态原子核外电子排布式为__________________。
②铜元素的电离能: ___________
___________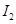 (填“>"或“<")。
(填“>"或“<")。
③反应中形成的化学键类型为_________________。
(2)硫酸铜与有机物X按1:2反应生成配合物M,其配离子结构如图。
已知A为第二周期元素。
①配合物M的晶体类型为________________。
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,这两种元素的电负性从大到小的顺序是_______________(填元素符号)。
③1 mo1有机物X中含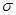 键的数目为________________。
键的数目为________________。
(3)Cu2+在生成[Cu(NH3)4]2+时,核外3d轨道上的1个未成对电子跃迁到4p轨道上,则Cu2+的轨道杂化方式不是sp3的原因是________________________。
[化学-物质结构与性质]碳、氮、氧、铁、铜是常见的几种元素,请回答以下问题:
(1)已知碳、氧、氯三种元素可形成CCl4、ClO:等物质,则C,O、Cl的电负性从大到小的顺序为______。
(2)基态铜原子的核外电子排布式为___________________________。
(3)三氯化铁常温下为固体,熔点282~C,沸点315~C,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为_________。
(4)lmolCH3COOH分子中含有ɑ键数目为___________。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
①维生素B1中碳原子的杂化轨道类型有__________________
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________________。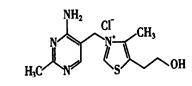
| A.离子键、共价键 | B.离子键、氢键、共价键 |
| C.氢键、范德华力 | D.离子键、氢键、范德华力 |
(6)通常酸式盐在水中的溶解度大于正盐,但NaHCO3,的溶解度却小于Na2C03,这是由于____________。
选考[化学一选修3:物质结构与性质]砷化稼为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。己知砷化稼的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是____(填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能As>Ga |
| C.电负性As>Ga |
| D.原子半径As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。
[化学—选修3:物质结构与性质](15分)
Ⅰ.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:C20分子共有 个正五边形,共有 条棱边。
Ⅱ.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有π键的数目为 。该分子中碳原子的杂化轨道类型是 ,该分子属于 分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为 。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药。
(1)Ni2+基态核外电子排布式为 。
(2)ClO4-的空间构型是 ;与ClO4-互为等电子体的一种分子为 (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为 ;1molCO(N2H3)2分子中含有σ键数目为 。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a∶b∶c= 。
(12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A.【物质结构与性质】
氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
(1)Zn2+基态核外电子排布式为________。
(2)与水分子互为等电子体的一种阴离子是________(填化学式)。
(3)氮化镓(GaN)的晶体结构如图1所示,其中氮原子的杂化轨道类型是________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是________。
(4)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。 不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为________。
(5)某种ZnO晶体的晶胞如图2所示,与O2-距离最近的Zn2+有________个。
( 在5-氨基四唑(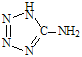 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为 ;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为 ;
在1mol 5-氨基四唑中含有的σ键的数目为 。
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为 。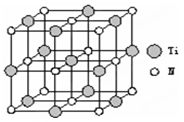
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 。(填写元素符号)
④[Ti(OH)2(H2O)4]2+中的化学键有 。
| A.σ键 | B.π键 | C.离子键 | D.配位键 |
(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。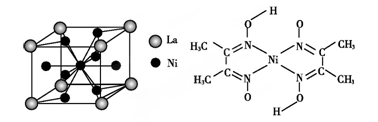
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
试题篮
()