过渡金属的某些氧化物能在常温下催化氧化空气中的一氧化碳和甲醛,如铜锰氧化物(CuMn2O4)等。
(1)铜元素位于第4周期第ⅠB族。基态Cu+的核外电子排布式为________。SO42-的空间构型为________。
(2)HCHO中含有的σ键和π键数目之比为_________________。
(3)火山喷出的岩浆中含有多种硫化物,冷却时ZnS比HgS先析出,原因是_______________。
(4)CuCl的盐酸溶液能吸收CO形成配合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图所示。
下列说法不正确的是___________
| A.该配合物质只含有离子键和配位键 | B.该配合物中Cl原子的杂化类型为sp3 |
| C.该配合物只有CO和H2O作为配体 | D.CO与N2的价电子总数相同,其结构为 |
(5)请判断键角NF3____ NH3,其原因是_________________________。
(6)Cu3N形成的晶体结构如图所示。则与同一个N3-相连的Cu+有______个,Cu+的半径为a pm,N3-的半径为b pm,则Cu3N的密度为___________g/cm3。
【化学一一选修物质结构与性质】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)X元素在周期表中的位置是 ,它的外围电子的电子排布图为 。P元素属于 区元素,
(2) 分子的空间构型是 ,
分子的空间构型是 , 分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其因是 。
(4)元素M与元素Q形成晶体结构如图1所示设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。求该晶胞密度的计算式为 

(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。三聚氰胺分子中氮原子轨道杂化类型是 ,1 mol三聚氰胺分子中o键的数目为 。
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第四周期第ⅠB 族。Cu2+的核外电子排布式为 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图2:下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是: 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因: 。
(6)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
选做(15分)【化学选修3:物质结构与性质】
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满。请回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)已知YZ2+ 与XQ2互为等电子体,则l mol YZ2+ 中含有π键数目为 。
(3)Z的气态氢化物沸点比Q的气态氢化物高得多,其原因是 。
(4)Y、Z与氢元素可形成化合物HYZ3,是实验室常用试剂。HYZ3分子中Y的杂化方式为 ,YZ3—的空间构型是 。
(5)E原子的价层电子排布式为 ;E有可变价态,它的基价态的离子与Z的阴离子形成晶体的晶胞如图所示。
①该晶体的化学式为 ,Z的阴离子的配位数为 。
②Z的阴离子的堆积模型为 。
A.简单立方 B.六方最密 C.面心立方
③已知晶胞边长为apm,则晶胞的密度为 g• cm—3(阿伏加德罗常数用NA表示)。
碳元素在自然界中分布很广,在地壳中其丰富程度位列第14位,远低于氧、硅、铝、铁等元素。但是,碳却是存在形式最复杂的元素,如煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等。请回答下列问题:
(1)基态碳原子的电子排布式为 。
(2)在CO2分子中,碳原子采用 杂化轨道与氧原子成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2分子的空间构型为 。
(4)二茂铁(5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲( ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。

(5)普鲁士蓝可用作染料,它的结构如图2所示。
普鲁士蓝中,n(K+)∶n(Fe3+)∶n(Fe2+)∶n(CN-)= 。
(6)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃C22-的存在,使晶胞沿一个方向拉长(如图3)。CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 。
已知CaC2晶体密度为ag·cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为 cm3。
(12分)【化学——物质结构与性质】硼在半导体工业中被大量用作半导体掺杂物,同时含硼化合物在杀虫剂、防腐剂及新型储氢材料的制造中也有重要的地位。请回答下列问题:
(1)在第2周期的元素中,基态原子的第一电离能小于硼的元素有_________种。
(2)硼砂是人们最早使用的含硼化合物之一,其阴离子Xm-( Xm-中只含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型分别为_____、_____;图中标注为2号的原子与相邻原子成键形成的键角_____4号原子与相邻原子成键形成的键角(填“大于”“小于”或“等于”)。在下列各项中,在Xm-内不存在的化学键是____(填下列序号字母)。
a.离子键 b.共价键 c.配位键
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料。镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=____。氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作______(填下列序号字母)。
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头
(本题15分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为__________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为___________;
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因_________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu===2Fe2++Cu2+,请写出其第l步反应的离子方程式__________________________________。
【化学—物质结构与性质】金属及其合金应用广泛。
(1)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是___________________。
(2)下图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b点对应的元素为______(填元素符号)。
(3)乙醇可被三氧化铬(CrO3)氧化为乙醛(CH3CHO)。乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是_____________________。
(4)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(5)元素Al与元素Fe形成某种晶体结构如图所示。若晶胞的边长为a nm,则合金的密度为_______g·cm—3。
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)Se原子中电子占据的最高能层符号是________,该能层具有的原子轨道数为 ,其核外M层电子的排布式为________;
(2)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________;
(3)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________,SO42-离子的立体构型为________;
(4)含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n="0" 弱酸,n="1" 中强酸,n=2强酸,n="3" 超强酸。
据实验事实可知硼酸(H3BO3)是一元弱酸,而亚磷酸是中强酸(H3PO3)
①写出硼酸(H3BO3)的电离方程式 。
②写出亚磷酸与过量的NaOH反应的化学方程式 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,ZnS的密度为d g·cm-3,则其晶胞中a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
选修:物质结构与性质】(铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 ______
(2)k3[Fe(CN)6]溶液可用于检验 ______(填离子符号)CN-中碳原子杂化轨道类型为 ____,C、N、O三元素的第一电离能由大到小的顺序为 ___(用元素符号表示)。
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
(4)铜晶体铜碳原子的堆积方式如右图所示。


①基态铜原子的核外电子排布式为 ________________。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 _______(填“离子”、“共价”)化合物。
③已知该晶体的密度为 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。
卤族元素的单质和化合物很多,请用物质结构与性质的相关知识回答:
(1)在一定浓度的氢氟酸溶液中,存在(HF)n缔合分子,使HF分子缔合的作用力是___。
(2)ClO4-中心氯原子的杂化方式为_____,离子的立体构型为__________。
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的分子结构分别如图I、II所示:请比较酸性强弱:HIO3_____H5IO6(填“>”、“<”或“=”)。H5IO6分子中σ键与π键的个数比为 。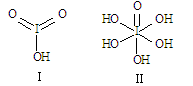
(4)下图为碘晶体晶胞结构。有关说法中正确的是___。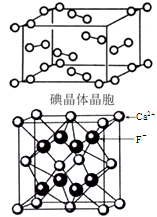
| A.用均摊法可知平均每个晶胞中有4个碘原子 |
| B.碘晶体中分子的配位数为12,具有分子密堆积特征 |
| C.碘晶体中存在的相互作用有非极性键和范德华力 |
| D.碘晶体中碘分子有3种排列方向 |
(5)观察CaF2晶胞结构,判断F-占据Ca2+ 形成的 面体空隙中,Ca2+ 占据F-形成的 面体空隙中。若相邻两个Ca2+ 的核间距为a cm,晶胞密度为ρ g/cm3,NA为阿伏加德罗常数,则CaF2的摩尔质量可以表示为________g/mol。
【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。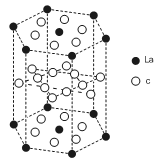
【化学—选修3物质结构与性质】已知:碳、氮、氢、氧四种元素可形成多种化合物,且有非常重要的用途。
(1)C、N、H电负性的大小顺序为 。
(2)甲烷与二氧化氮可发生如下反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ,若反应中有2mol C-H键断裂,则形成的π键共有 mol。
(3)F2与NH3在一定条件下可形成NF3,NF3分子的空间构型为 形 。
(4)现已合成出一种硬度比金刚石还大的晶体氮化碳,其化学式为 。其硬度比金刚石大的主要原因是 。
(5)配合物Y的结构如图所示,Y中含有 (填序号)。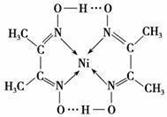
A.非极性共价键
B.配位键
C.极性键
D.氢键
E.金属键
Y中碳原子的杂化方式有 。
写出镍(Ni)原子的价电子排布式 。
(6)氨气与铁在一定条件下发生置换反应,一种产物的晶胞结构如下图所示,若该立方体晶胞的棱长为a pm,则该晶体的密度为 g/cm3(NA为阿佛加德罗常数的值)。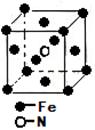
试题篮
()