黑火药是中国四大发明之一,其爆炸的化学反应方程式是:
2KNO3 + 3C + S→ + N2↑ + 3CO2↑
+ N2↑ + 3CO2↑
(1)方程式中第二周期元素中非金属性由强到弱的顺序依次为 。
(2)上述元素中,元素原子最外层有2个未成对电子的是 。
(3)在生成物中:A物质的晶体类型为 ;构成晶体A的微粒半径大小关系为 (用微粒符号表示);含极性共价键的非极性分子为 。
(4)已知CN—与N2结构相似,写出HCN分子的结构式 。
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电。下列有关分析正确的是
| A.K3C60和C60中都含有共价键 |
| B.钾的核外电子排布为:1s22s22p63s23p63d104s1 |
| C.K3C60和C60都属于分子晶体,具有较低的熔点 |
| D.C60与12C互为同素异形体 |
X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增。Y、Z、M是同周期元素,且Z、M最外层电子数之差为1。X+ 无电子,—ZX是有机物中常见官能团。Y是组成化合物最多的元素,组成为R ZX的物质能溶解W2Z3型物质。下列说法不正确的是
| A.由X与Y组成的化合物的沸点可能高于由X与Z组成的化合物的沸点 |
| B.X、Z、R三种元素中的任意两种组合成的(1∶1型)物质中均含有共价键 |
| C.常压条件下,沸点:X2Z2>XM ;简单离子半径:Z>M>R>W |
| D.R 3WM6晶体可作为工业电解熔融W2Y3制W单质时的助熔剂 |
碳与硅是十分重要的两种元素,金刚石、SiC具有耐磨、耐腐蚀特性,应用广泛。
(1)碳元素在周期表中的位置是_______________,其原子核外通常未成对电子数为___________个。
(2)已知2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)反应中,被破坏的化学键有________。
a.离子键 b.极性共价键 c. 非极性共价键
(3)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,除去粗产品中少量钠的试剂为_______________。
(4)下列叙述正确的有____________填序号),
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③NaSiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④Si在一定条件下可与FeO发生置换反应
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
下列说法正确的是( )
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| D.NCl3分子中所有的原子均为8电子稳定结构 |
A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是
A.A元素的单质可以把B元素的单质从NaB溶液中置换出来
B.NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高
C.HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol
HB分子中H-B键断裂时吸收的能量多
D.常温下,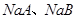 溶液的pH均大于7
溶液的pH均大于7
根据相关的化学原理,下列判断正确的是
| A.由于水中存在氢键,所以稳定性:H2O>H2S |
| B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 |
| C.若A2 + 2D— ="=" 2A— + D2,则氧化性D2>A2 |
| D.若R2—和M+的电子层结构相同,则离子半径R2—>M+ |
喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( )
气体 |
溶液 |
|
A. |
H2S |
稀盐酸 |
B. |
HCl |
稀氨水 |
C. |
NO |
稀H2SO4 |
D. |
CO2 |
饱和NaHCO3溶液 |

A.AB.BC.CD.D
下列说法正确的是
| A.原子最外层电子数为2的元素一定处于周期表的第IIA族 |
| B.构成单质的分子中一定含有共价键 |
| C.同主族元素形成的氧化物的晶体类型均相同 |
| D.金属与非金属元素形成的化合物可能是离子化合物 |
[物质结构与性质]过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol 中含有σ键的数目为 。
中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为 。
依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
| A.依据元素的原子序数,推断该元素原子的核外电子数 |
| B.依据原子最外层电子数的多少,推断元素金属性、非金属性的强弱 |
| C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
下列说法正确的是
| A.氢键、分子间作用力、离子键、共价键都是微粒间的作用力。其中分子间作用力只影响物质的熔沸点而不影响物质的溶解性。 |
| B.石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向。 |
| C.H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象。 |
D.原子结构模型的演变经历了: |
下列关于物质结构与性质的叙述中,正确的是( )
| A.氢键的存在一定会使物质的熔点升高 |
| B.因为蛋白质分子与胶体粒子大小相近,故蛋白质溶液具有胶体的某些性质 |
| C.丁达尔现象是胶体粒子对光线反射形成的,可以用于区分胶体和悬浊液 |
| D.可以用电子气理论解释大多数金属容易发生锈蚀的性质 |
试题篮
()