(14分)A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为 。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为 。
(3)C、D、E元素的第一电离能由大到小的顺序是 。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是 ,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是 。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为 ,C离子的配位数是 。
【原创】X、Y、Z、Q、R、W为周期表中前四周期的元素,其原子序数依次增大。已知:X的基态原子核外电子有6种运动状态,Y的气态氢化物水溶液呈碱性,Z元素基态原子的s能级与p能级上的电子数相等,Q的一种核素质量数为37,中子数为20,R2+与Z—具有相同的核外电子排布,W原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)W在周期表中位于 区,其基态原子价电子排布式为 。
(2)X、Y、Z的第一电离能由大到小的顺序为___ _(用元素符号表示)。
(3)Y、Q两种元素可形成YQ3形化合物,其中心原子杂化方式为 ,分子的空间构型为 。
(4)Y的氢化物易溶解在Z的氢化物中,其原因是 。
(5)已知YZ2+写XZ2互为等电子体,写出YZ2+的电子式 。
(6)Y的一种液态氢化物(Y2H4)与液态Y2Z4发生反应生成Y2(g)和H2Z(l):反应中若形成1molπ键放热a KJ,写出该反应的热化学方程式 。
(7)RX2晶体的晶胞结构与NaCl晶体相似(如图),但RX2晶体中哑铃形X22-的存在,使晶胞沿一个方向拉长。RX2晶体中1个R2+周围距离最近的X22-数目为 。

(化学——物质结构与性质,13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
| A |
|
|
||||||||||||||||
| |
|
|
|
M |
Q |
R |
|
|
||||||||||
| |
|
E |
|
|
|
D |
|
|||||||||||
| |
|
|
G |
|
|
|
J |
|
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有 个。该晶体属于 晶体
A.离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种 分子(填极性或非极性)。
(3)请写出D-的电子排布式: 。
(4)M2A2也是直线型分子,1个分子中含有 个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式(用元素符号表示) 。
某叶绿素的化学式为C55 H72N4O6Mg,其在人体代谢的中间产物为CO( NH:2)20。
(1)该叶绿素所含元素中,基态原子第一电离能最大的是 (填元素符号,下同);处于s区的元素有 。
(2)已知CO( NH2)2分子中C、N、O原子均达8电子稳定结构,其中N的杂化轨道类型为 ;在CO(NH2)2晶体中存在____ (填序号)o
A.非极性键 B.极性键 C.氢键 D.范德华力
(3)CO(NH2)2的熔点远远低于NaCl.其原因是 。
(4)工业上,用惰性电极电解法除去碱性溶液中的CO( NH2)2,产物均为无毒无害常见物质。则阳极除去CO(NH2)2的电极反应式为 。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)请写出元素d的基态原子电子排布式________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是_______。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
(7分)
(1)NF3分子中N原子的杂化轨道类型为__________,该分子的空间构型为________
(2)[Cu(NH3)4]SO4属于配合物,其中 原子提供孤对电子。配合物 Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,Fe(CO)5晶体属于 (填晶体类型)。
(3)金属铜晶体的晶胞结构如图所示(面心立方晶胞):若该晶胞边长为dnm,铜的相对原子质量为64,阿伏加德罗常数为NA,则该晶体的密度为 g/cm3(列表达式)
[化学——选修3:物质结构与性质]已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,
化合物的化学式,甲为________,乙为____________;高温时,甲易转化为乙的原因为____________。
【化学—选修3—物质结构与性质】(12分)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为_____________。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______________。
(3)与CN-互为等电子体的一种分子为________________(填化学式);l mol Fe(CN)63-中含有σ键的数目为________________。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______________(填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小 体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为____________。
【改编】有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置 ;E2+在基态时,核外电子排布式为 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是 (写分子式)。
(3)BD2分子的空间构型为________。B原子采用 杂化。
(4)B、C、D三种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
(5)C的单质分子的电子式为________。
(6)E能与C(非元素符号)形成一种磁性材料,其晶胞结构如图所示,则该磁性材料的化学式为 。

含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。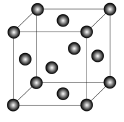
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于 分子(填“极性”或“非极性”)。
(2)当n=3时,A与B形成的晶体属于 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时核外电子排布式为 ,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是 。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。
【化学—选修3:物质结构与性质】
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。
则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。
如:Na2O+Cl2==2NaCl+ O2 2CaO+2Cl2==2CaCl2+O2
O2 2CaO+2Cl2==2CaCl2+O2
SiO2+2CCl4==SiCl4+2COCl2 Cr2O3+3CCl4==2CrCl3+3COCl2
请回答下列问题:
(1)COCl2俗称光气,分子中C原子采取sp2杂化,则该分子的结构式是 ,分子的立体构型是 。
(2)写出CCl4的电子式 ,与CCl4互为等电子体的分子和离子分别有 和 (各举一例,写化学式)。
(3)比较下列物质的熔点,用“>”“<”或“=”填写。
Na2O NaCl
CCl4 SiCl4
(4)石英的主要成分是SiO2,晶体类型是 晶体,实验室 (选填“能”或“不能”)用石英坩埚融化氢氧化钠固体。
(1)光气(COCl2)是一种应用广泛的原料,下列分子的构型与COCl2分子构型相同的是________(填序号,下同),属于非极性分子的是________。
| A.甲醇(CH4O) | B.甲醛(CH2O) | C.NH3 | D.CO2 |
甲醇(CH4O)与甲醛(CH2O)的相对分子质量相近,通常情况下甲醇呈液态而甲醛呈气态,原因是 。
(2)Fe、Al、Cu三种元素基态原子中未成对电子最多的是________(填元素符号)。
(3)CaC2中C22-与O22+互为等电子体,1 mol O22+中含有的π键数目为________。
(4)已知NaCl、MgO的晶体类型相同,但MgO的熔点远远高于NaCl的熔点,原因是__________。
(选考)【化学——选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_____________,该能层具有的原子轨道数为____________________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是____________________。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
试题篮
()