下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1、02 |
2、27 |
0、74 |
1、43 |
0、77 |
1、10 |
0、99 |
1、86 |
0、75 |
1、17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: 。(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是 。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形成 个σ键, 个π键。
(3)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第 族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
②不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是 。
Ⅰ.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)若知上述反应每产生2.24LCO气体(折为标准状况)放出Q kJ的热量,则其热化学方程式为 
(3)用轨道表示式表达Si 核外电子排布情况 
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4中硅的化合价为 ,Si3N4所属的化合物类型是 (填离子化合物or共价化合物),在前四周期的元素中,未成对电子数最多的元素的电子排布式为
Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染 。例如:
。例如:
CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(17分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)B 、D两种元素的氢化物中,沸点大的是 (写化学式号),其原因是
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”,用元素符号表示)
(5)E位于周期表的第 周期,第 族;其原子结构示意图为 。
(6)A与B形成的A2B2化合物含 键(填“极性”或“非极性”),属 分子。(填“极性”或“非极性”)其电子式为:______________________________。
下表中a、b、c…为周期表中部分元素,回答下列问
| a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
f |
y |
h |
i |
|
| |
b |
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
j |
|
| c |
|
|
|
|
|
|
d |
|
|
|
g |
|
l |
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在表中用线画出元素周期表的边界
(2)请写出上述元素d3+的核外电子排布式 ;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序 (写元素符号),判断依据是:
(4)请写出e元素的原子价电子轨道表示式 ;
(5)ya3分子的电子式是 ,其分子的空间构型是 。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________ 。
.下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的,写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaC1、MgC12等。请回答
(1)冰比硫化氢熔点高的原因是 ;
其分子中氧原子的杂化轨道类型为 ;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol—1 |
I1 |
I2 |
I3 |
I4 |
| X |
578 |
1817 |
2745 |
11578 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
496 |
4562 |
6912 |
9543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示);
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图。
①铁元素基态原子价电子排布式为 ;
②已知CN—与N1结构相似,1mol CN-中 键数目为 。
键数目为 。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
| A |
|
R |
|||||||||||||||
| B |
|
|
|
|
|
|
|
|
|
|
|
C |
D |
E |
F |
T |
|
| G |
H |
I |
J |
|
K |
L |
|
||||||||||
| |
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为_______ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为 。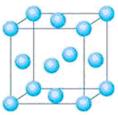
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
阅读下表中短周期主族元素的相关信息。
请回答:
(1)写出E在元素周期表中的位置:________;C的简单离子的结构示意图:______;
(2)写出A2B2晶体中存在的化学键有:_______________________;
(3)常温下,0.1 mol·L-1X溶液的pH 7(填“>”、“=”或“<”)。简述X可以做家用消毒剂的理由:_______________________________________。
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 _________________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________________,其原因是____________________;
②电子总数相同的氢化物的化学式和立体结构分别是_________________________.;
(5)W和Q所形成的结 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________
(15分)(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知 :
:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得: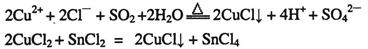
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: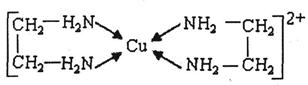
请回答下列问题:
(1)基态Cu原子的核外电子排布式为 。H、N、O三种元素的电负性由大到小的顺序是  。
。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为
。
(3)乙二胺分子 中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
(4)②中所形成的配离子中含有的化学键类型有_______。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_____。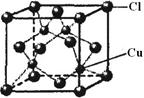
(12分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下 表。
表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外 共有 种不同运动状态的电子,有 种不同能级的电子。
共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化 物中,沸点由高到低
物中,沸点由高到低 的排列次序依次为(写化学式) 。
的排列次序依次为(写化学式) 。
(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]C l3 B.[R(H2O)5Cl]Cl2·H2O
l3 B.[R(H2O)5Cl]Cl2·H2O
C. [R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不 污染环境,其反应的化学方程式为 。
污染环境,其反应的化学方程式为 。
下表是元素周期表的一部分,表中所列字母分别代表一种化学元素:

试回答下列问题:
(1 )
) 按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。
按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。
(2)请写出字母o代表的元素的基态原子外围电子排布式 。
(3)第三周期8种元素按单质熔点高低的顺序如图,其中 序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(5)COCl2俗称光气,分子中C原子采取 杂化方式成键;分子中的共价键含有 (填标号)。
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1 个π键
个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2] 分子的空间构型
是 。若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A分子的几何构型图 。
A、B、C、D、E为五种短周期元素,且原子序数依次增大。其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数。C原子的最外层中有两个不成对的电子。D、E的原子核内各自的质子数与中子数相等。C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素)。已知在DC2和EC2中,D与C的质量之比为7:8;E与C的质量之比为1:1。请回答下列问题:
(1)基态D原子的电子排布式为 ,单质B2中 键与
键与 键的数目之比为
键的数目之比为
(2)化合物BH3(H代表氢元素)的立体构型为____,B原子的杂化轨道类型 是 。
(3)C和E的最简单氢化物分别为甲和乙,请比较相同条件下甲、乙的沸点大小,并说明理 。
(4)A可以形成多种结构不同的单质,其中M是所有已知晶体中硬度最大的,其晶体类型是 ;若该晶体晶胞(如图所示)的边长为a cm,则其密度是 g·cm -3(只要求列式,不必计算出数值,阿伏加德罗常数为NA)。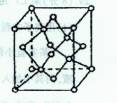
Ⅰ、氯化铬酰(CrO2Cl2)在有机合成中可作 氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
⑴写出铬原子的基态电子排布式_____________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有_____(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为 。
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断
CrO2Cl2是_______(填“极性”或“非极性”)分子。
⑶在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4 ⑥CH3Cl ⑦HCOOH七种有机物质中,碳原子采取sp2杂化的分子有________(填序号),CS2 分子的空间构型是_______。
分子的空间构型是_______。
Ⅱ、不锈钢是由铁、铬、镍、碳及众多不同元素所组 成的合金。
成的合金。
(1)基 态碳(C)原子的价电子排布式为 。
态碳(C)原子的价电子排布式为 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr3+的配位数为 ;[Cr(H2O)4Cl2]Cl中含有的化学键为 。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO )4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于 (填序号)。
)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于 (填序号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(4)据报道,只含镁、镍和碳三 种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中
种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中 每个镁原子周围距离最近的镍原子有 个。
每个镁原子周围距离最近的镍原子有 个。
核能源已日益成为当今世界的主要能源。
(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2(CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如图),则UO2晶体U4+的配位数为 ;三碳酸铀酰铵中含有化学键类型有 ;
| A.离子键 | B.  键 键 |
C.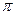 键 键 |
D.氢键 E.配位键 |
根据价层电子对互斥理论推测CO32—的空间构型为 ;写出一种与CO32—互为等电子体且属于非极性分子的微粒的化学式 。
(2)为了获得高浓度235U,科学家们采用“气体扩散法”;到目前为止,UF6是唯一合适的化合物。UF6在常温常压下是固体,在56.4℃即升华成气体。UF6属于 晶体。
(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以为核爆炸或核反应堆泄漏事故的信号核素。写出131I基态原子的价电子排布式 。
试题篮
()