锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛。
(1)Li-SOCl2电池总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2,该反应的反应物和生成物中不存在的相互作用是 (填序号)。
a.离子键
b.共价键
c.氢键
d.范德华力
e.金属键
(2)亚硫酰氯(SOCl2)中硫的化合价为 ,1molSOCl2中的σ键数目是 。S、O、Cl三种元素电负性从大到小的顺序是 。
(3)在Li-SOCl2电池的碳正极中加入金属酞菁配合物可提高电池的容量和寿命。右图为一种铁酞菁配合物的结构,其中M为Fe2+,写出Fe2+的价电子排布式 。请在图中用箭头表示出配位键。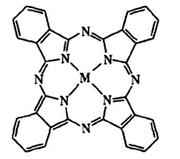
(4)人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的锂键。如LiF·HF中就存在锂键,下列LiF·HF的结构式正确的是(其中锂键用…表示) 。(填序号)
a. F—H…Li—F b.H—F…Li—F
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)Se原子中电子占据的最高能层符号是________,该能层具有的原子轨道数为 ,其核外M层电子的排布式为________;
(2)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________;
(3)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________,SO42-离子的立体构型为________;
(4)含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n="0" 弱酸,n="1" 中强酸,n=2强酸,n="3" 超强酸。
据实验事实可知硼酸(H3BO3)是一元弱酸,而亚磷酸是中强酸(H3PO3)
①写出硼酸(H3BO3)的电离方程式 。
②写出亚磷酸与过量的NaOH反应的化学方程式 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,ZnS的密度为d g·cm-3,则其晶胞中a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)。
【化学一选修3:物质结构与性质】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
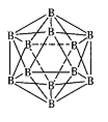
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,E2+核外电子有18种运动状态,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| |
A |
B |
C |
D |
E |
F |
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)F2+与NH3 形成配离子的结构式为 ;该配离子具有对称的空间构型,其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则该配离子的空间构型为 。往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
(3)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④);
(4)下图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出A的氢化物所在的折线 (填n、m、x或y)。
【化学——选修《物质结构与性质》】
I.信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为________.
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________.
A.金刚石 B.干冰 C.食盐 D.固态氨
(3)已知:2H2O H3O++OH-,H3O+的立体构型是______,含1molH2O的冰中最多可形成“氢键”___mol.
H3O++OH-,H3O+的立体构型是______,含1molH2O的冰中最多可形成“氢键”___mol.
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________.
II.A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
(1)A、C形成的化合物________(填序号).
①一定属于离子化合物
②一定属于共价化合物
③可能属于离子化合物,也可能属于共价化合物
(2)C原子的电子排布式为________.
(3)若A元素的原子最外层电子排布为1s1,写出A、C形成的含有配位键的一种微粒符号________.
(4)当n=2时,每个BC2中含有________个σ键,________个π键.当n=3时,B与C形成的晶体类型为________.
(5)若D元素与Fe形成某种晶体,该晶体的晶胞如图所示.则该晶体的化学式是________(用元素符号表示);若晶胞的边长为a nm,则合金的密度为________g/cm3.
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。
选考[化学一物质结构与性质]铜是应用较为广泛的有色金属。
(1)基态铜原子的核外电子排布式为 。
(2)金属化合物Cu2Zn合金具有较高的熔点、较大的强度、硬度和耐磨度。Cu2Zn合金的晶体类型是 。
(3)某含铜化合物的离子结构如图所示。
①该离子中存在的作用力有 ;
a.离子键
b.共价键
c.配位键
d.氢键
e.范德华力
②该离子中第二周期的非金属元素的第一电离能由大到小的顺序是 ;
③该离子中N原子的杂化类型有 。
(4)铜与氧形成化合物的晶体结构如图。该化合物的化学式为 ,O的配位数是 。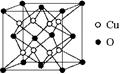
本题由两小题构成,共16分。
Ⅰ、(8分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族。B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。
(1)A和E所形成化合物的电子式是__________。
(2)A、B、C、D四各元素的原子半径由小到大的顺序为__________(用元素符号表示)。
(3)A和E形成的化合物的晶体中,每个阳离子周围与它最近且距离相等的阳离子共有_________个。
(4)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22 cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)__________。
Ⅱ.(8分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是________________________。
氮(N)元素与多种元素可以形成多种化合物。
(1)NH4Cl受热分解时克服的化学键有 ;NH4Cl晶体不能导电的原因是 。
(2)N、H元素除了可以形成10电子分子NH3外,还可形成18电子分子肼,肼的结构简式为NH2—NH2。若将肼分子中的2个H原子替换为甲基(—CH3),所得分子的结构简式可能为 、 。
(3)平面型BF3很容易与特定化合物[如N(CH3)3]以配位键形成四面体配位化合物,请在下图中用“→”标出B、N原子间存在的配位键。
(4)氮化硼(BN)是一种新型无机非金属材料,氮化硼有两种重要晶型A型和B型。A型氮化硼硬度很高,是特殊的耐磨和切削材料;B型氮化硼化学稳定性较好,是一种优良的润滑剂。A型氮化硼结构下图中 (选填“I”或“Ⅱ”)所示。工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得,写出该反应的化学方程式 。
(5)氢氧化铜与氨水形成铜氨溶液,已知[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (选填“平面四边形”或“正四面体”)。[Cu(NH3)2]+在空气中立即转化为深蓝色的[Cu(NH3)4]2+,简述发生转化的可能原因 。
(6)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。该沉淀包含一种正四面体型的阳离子和一种三角锥型的阴离子,摩尔质量为162g/mol,且Cu、S、N的物质的量之比为1:1:1,则该白色沉淀的化学式为 。
【化学——选修3 物质结构与性质】A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)B,D可分别与A形成只含一个中心原子的共价化合物X和Y,其中X的电子式为 ;Y采取的杂化轨道类型为 ;C与A形成的常见化合物的分子构型为 。
(2)B和D的最高价氧化物的晶体中熔点较高的是(填化学式) ,其原因 。
(3)B与C比较电负性较大的是 (填元素符号),E2+的核外电子排布式为 。
(4)E2+与C的常见氢化物形成的配离子的离子反应方程式为 。
(5)铝单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。若已知铝原子半径为d,NA表示阿伏加德罗常数,摩尔质量为M,则该原子的配位数 ,该晶体的密度可表示为______________,据下图计算,Al原子采取的面心立方堆积的空间利用率为 __________。
(选考)水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
在该离子中,存在的作用力有______________。
a.配位键
b.极性键
c.非极性键
d.离子键
e.金属键
f.氢键
g.范德华力
h.π键
i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图为冰的一种骨架形式,依此为单位向空间延伸。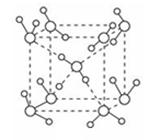
①该冰中的每个水分子有_________个氢键;
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。下图的五角十二面体是冰熔化形成的理想多面体结构。假设图中的冰熔化后的液态水全部形成下图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3(已知2952=8.70×104,2953=2.57×107, =1.41,
=1.41, =1.73)。
=1.73)。
[化学——选修3:物质结构与性质](15分)As、N、O等非金属元素的化合物在工业生产中有重要的应用。
(1)核电荷数比As小4的元素基态原子的电子排布式为 。
(2)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(3)已知氮的最高价氧化物为无色晶体.它由两种离子构成,其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
(4)磷化硼有多种晶型,下图示意的是磷化硼分子的分子结构图,其分子式为 。
(5)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如下图所示。由此判断该钙的氧化物的化学式为 。已知该氧化物的密度是ρg·cm -3.则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。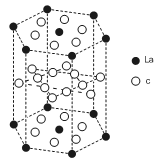
含碳物质具有许多优良性质。
(一)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。
(1)下列说法中,正确的是 。
A.固态时,碳的各种单质的晶体类型相同
B.石墨烯只含有非极性键
C.从石墨剥离得石墨烯需要破坏化学键
D.石墨烯具有导电性
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜等或合金,含碳源可以是乙炔、苯、乙醇等中的一种或任意组合。
①乙醇和二甲醚(H3C—O—CH3)是同分异构体,二甲醚的沸点比乙醇 (填“高”或“低”),原因是 。
②铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(二)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
(3)已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为 145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由 。
(4)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ,Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
碳元素在自然界中分布很广,在地壳中其丰富程度位列第14位,远低于氧、硅、铝、铁等元素。但是,碳却是存在形式最复杂的元素,如煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等。请回答下列问题:
(1)基态碳原子的电子排布式为 。
(2)在CO2分子中,碳原子采用 杂化轨道与氧原子成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2分子的空间构型为 。
(4)二茂铁(5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲( ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。

(5)普鲁士蓝可用作染料,它的结构如图2所示。
普鲁士蓝中,n(K+)∶n(Fe3+)∶n(Fe2+)∶n(CN-)= 。
(6)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃C22-的存在,使晶胞沿一个方向拉长(如图3)。CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 。
已知CaC2晶体密度为ag·cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为 cm3。
试题篮
()