【化学一选修3:物质结构与性质】(15分)己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的KLM能层为全充满结构。
回答下列问题:
(1)A、B、C、D几种元素中第一电离能最大的是____(填元素符号);D元素的原子核外有 种不同运动状态的电子:E原子M能层中具有的轨道数为__ 。
(2)F有两种常见的离子,画出低价态离子价电子排布图 ____.在这两种离子之间 更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:____ 。
(3)由A、B、C、D四种元素形成的某种离子化合物,其原予个数比为4:1:2:11,科学家第一次合成有机物利用的便是这种离子化合物,请根据等电子体原理写出该离子化合物的电子式:____ 。
【化学一一选修物质结构与性质】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)X元素在周期表中的位置是 ,它的外围电子的电子排布图为 。P元素属于 区元素,
(2) 分子的空间构型是 ,
分子的空间构型是 , 分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其因是 。
(4)元素M与元素Q形成晶体结构如图1所示设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。求该晶胞密度的计算式为 

(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。三聚氰胺分子中氮原子轨道杂化类型是 ,1 mol三聚氰胺分子中o键的数目为 。
科学家正在研究温室气体
和
的转化和利用。
(1)
和
所含的三种元素电负性从小到大的顺序为。
(2)下列关于
和
的说法正确的是(填序号)。
a.固态
属于分子晶体
b.
分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以
熔点低于
d. 和 分子中碳原子的杂化类型分别是 和
(3)在
基催化剂作用下,
和
反应可获得化工原料
和
.
①基态
原子的电子排布式为,该元素位于元素周期表的第族。
②
能与
形成正四面体形的配合物
,1
中含有
键。
(4)一定条件下,
和
都能与
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
与
形成的水合物俗称"可燃冰"。
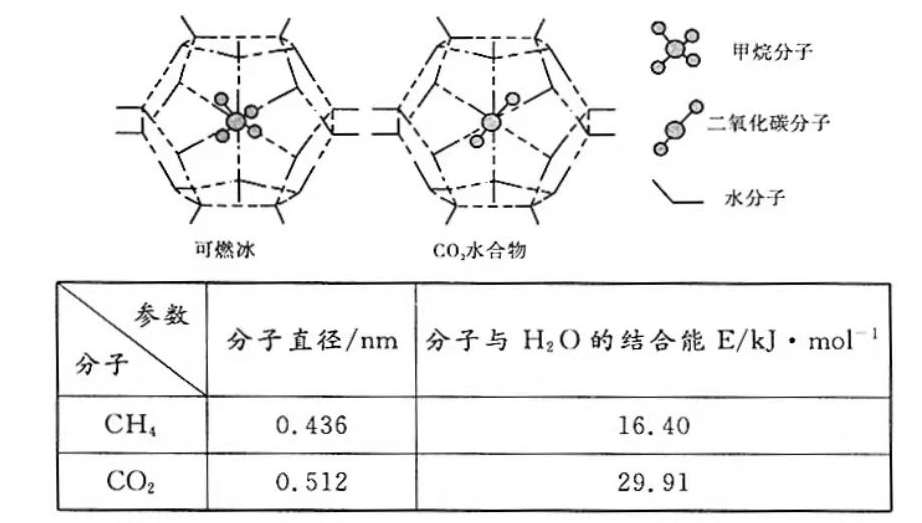
①"可燃冰"中分子间存在的2种作用力是。
②为开采深海海底的"可燃冰",有科学家提出用
置换
的设想。已知上图中笼状结构的空腔直径为0.586
,根据上述图表,从物质结构及性质的角度分析,该设想的依据是。
(选考)水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
在该离子中,存在的作用力有______________。
a.配位键
b.极性键
c.非极性键
d.离子键
e.金属键
f.氢键
g.范德华力
h.π键
i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图为冰的一种骨架形式,依此为单位向空间延伸。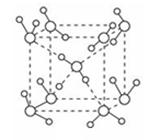
①该冰中的每个水分子有_________个氢键;
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。下图的五角十二面体是冰熔化形成的理想多面体结构。假设图中的冰熔化后的液态水全部形成下图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。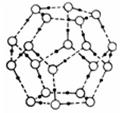
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3(已知2952=8.70×104,2953=2.57×107, =1.41,
=1.41, =1.73)。
=1.73)。
(13分) X、Y、Z、R为短周期元素,原子序数依次增大。X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等。
(1)R位于元素周期表第_①_____周期,第_②______族。
(2)X、R元素的最高价氧化物对应的水化物中,酸性较强的是_______。(填化学式)
(3)Y元素所在周期中,电负性最大的元素是_______。
(4)X和R形成的物质是一种超硬材料,其晶胞结构如图所示,晶胞中X原子的个数是________。
(5)X的单质完全燃烧生成的产物分子中,σ键与π键的数目之比是_______。
(6)Y和Z所形成的化合物ZY难溶于水,但易发生水解。ZY在NaOH溶液中水解的离子方程式是__________________________________________。
乙炔是有机合成工业的一种重要原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ,1mol O22+中含有的π键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液中生成红棕色沉淀Cu2C2。Cu+简写的核外电子排布式为 。
(3)乙炔与HCN反应可得到丙烯腈(CH2=CH—C≡N), 丙烯腈分子中碳原子轨道的杂化类型是 ;分子中处于同一直线上原子数目最多有 个。
(4)CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中哑铃形的C22-的存在,使晶胞沿一个方向拉长, CaC2晶体中一个Ca2+周围距离最近的C22-数目为 。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
【化学—选修3:物质结构与性质】(15分)A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,C的氢化物水溶液呈碱性;D的基态原子3p轨道上有3个未成对电子;E、F为副族元素,4s能级均只有一个电子。回答下列问题:
(1)A、B、C三种元素按电负性由小到大的顺序是_________(用元素符号表示)。
(2)B与氧原子能形成四原子阴离子,其中B的杂化方式为_____________;C的三氯化物分子的立体构型为____________________________________。
(3)任写一种与BC—离子互为等电子体的离子__________________(写出化学式)。
(4)F原子的外围电子排布式为_____________,F晶体中原子的堆积方式是下图中的_________(填写“甲”、“乙”或“丙”)。
(5)E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体。该晶体中E3+、Cl—、H2O的物质的量之比为1∶3∶6,且E的配位数为6。向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g白色沉淀,则该配合物的化学式为__________________________。
(6)AD是一种耐磨材料,其结构与金刚石相似,下图为其晶体结构单元,它可由A的三溴化物和D的三溴化物于高温下在氢气的氛围中合成。
①写出合成AD的化学方程式:________________________。
②已知晶体中A与D原子的最近距离为a pm,则该晶体密度的表达式为_________g/cm3。(不需化简,阿伏加德罗常数为NA)
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1)G的基态原子的外围电子排布式为 ,周期表中F属于 区。
(2)B与F形成的一种非极性分子的电子式为 ;F的一种具有强还原性的氧化物分子的VSEPR模型为
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是___ __
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(1)主族元素A的简单阳离子不与任何原子具有相同的核外电子排布。元素B与氮元素同周期,B的原子序数大于氮,而第一电离能比氮的小。A与B形成两种化合物A2B2和A2B,其中B的杂化方式分别为 、 。A2B、NH3、SiH4的键角由大到小依次为 (填化学式)。A2B由液态形成晶体时密度减小,主要原因是 。
(2)新型无机材料在许多领域被广泛应用。陶瓷发动机的材料选用氮化硅,它硬度高、化学稳定性高,是很好的高温陶瓷材料。除氢氟酸外,氮化硅不与其他无机酸反应,抗腐蚀能力强。氮化硅的晶体类型是 ,氮化硅与氢氟酸反应的化学方程式为 。
(3)MgCO3和CaCO3都为离子晶体,热分解的温度分别为402℃和900℃,请根据结构与性质的关系说明它们热分解温度不同的原因 。
(4)砷化镓广泛用于雷达、电子计算机、人造卫星,宇宙飞船等尖端技术中。镓的基态原子价电子排布式为 ,砷化镓的晶胞结构与金刚石相似,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为 g(用NA表示阿伏加德罗常数),该晶胞中Ga与As的最短距离为 cm。
化学中的某些元素是与生命活动密不可分的元素,请回答下列问题。
(1)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。
①维生素C分子中碳原子的杂化方式有 。
②1 mol维生素C分子中含有 mol π键。
③维生素C分子中所含元素电负性由大到小的顺序 为 。
④维生素C晶体溶于水的过程中要克服的微粒间作用力有 。
(2)KSCN溶液可用于Fe3+的检验,原因是铁离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物。Fe3+的价电子排布为 ,与之形成配合物的分子或离子中的配位原子应具备的结构特征是 。
(3)Fe3O4具有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A、B方块组成。该化合物的化学式为________。
【化学—物质结构与性质】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)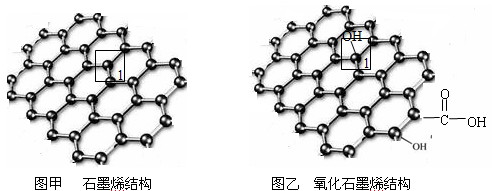
(1)图甲中,1号C与相邻C形成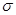 键的个数为____________________________。
键的个数为____________________________。
(2)图乙中,1号C的杂化方式是________________,该C与相邻C形成的键角_______(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有_________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为_____________,该材料的化学式为__________。
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛。
(1)Li-SOCl2电池总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2,该反应的反应物和生成物中不存在的相互作用是 (填序号)。
a.离子键
b.共价键
c.氢键
d.范德华力
e.金属键
(2)亚硫酰氯(SOCl2)中硫的化合价为 ,1molSOCl2中的σ键数目是 。S、O、Cl三种元素电负性从大到小的顺序是 。
(3)在Li-SOCl2电池的碳正极中加入金属酞菁配合物可提高电池的容量和寿命。右图为一种铁酞菁配合物的结构,其中M为Fe2+,写出Fe2+的价电子排布式 。请在图中用箭头表示出配位键。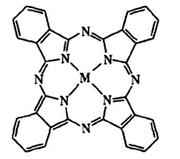
(4)人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的锂键。如LiF·HF中就存在锂键,下列LiF·HF的结构式正确的是(其中锂键用…表示) 。(填序号)
a. F—H…Li—F b.H—F…Li—F
(本题15分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为__________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为___________;
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因_________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu===2Fe2++Cu2+,请写出其第l步反应的离子方程式__________________________________。
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第四周期第ⅠB 族。Cu2+的核外电子排布式为 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图2:下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是: 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因: 。
(6)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
试题篮
()