电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为石墨电极。
下列有关描述错误的是
| A.阳离子交换膜是A,不是B |
| B.通电后阳极区的电极反应式:2Cl--2e-=Cl2↑ |
| C.工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 |
| D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
a mol FeS与b mol FeO投入到V L、c mol·L 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g
③3(a+b) mol ④ mol
mol
| A.②④ | B.②③④ | C.②③ | D.①②③④ |
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成化合物CE。下列说法正确的是
A.五种元素中原子半径最大的是E,最小的是A
B.A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物
C.E最高价氧化物对应水化物化学式为H2EO4
D.C的单质在空气中燃烧产物的化学式为C2O
有关晶体的结构如下图所示,下列说法中错误的是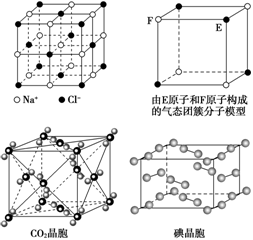
| A.在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
| B.该气态团簇分子的分子式为EF或FE |
| C.在CO2晶体中,一个CO2分子周围有12个CO2分子紧邻 |
| D.在碘晶体中,碘分子的排列有两种不同的方向 |
25℃下,向20 mL 0.1 mol·L-1H2A溶液中滴加0.1 mol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是

下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
根据下列各图曲线表征的信息,得出的结论不正确的是
| A.图l表示常温下向体积为10 mL 0. 1 mol•L-1NaOH溶液中逐滴加入0. 1 mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
| B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸.II表示盐酸,且溶液导电性:c>b>a |
| C.图3表示H2与O2发生反应过程中的能量变化,H2的然烧热为285. 8kJ mol-1 |
| D.由图4得出若除去CuSO4洛液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的PH至4左右 |
准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为
| A.1.75 mol·L-1 |
| B.3.50 mol·L-1 |
| C.0.85 mol·L-1 |
| D.无法确定 |
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是
| A.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
| B.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
| C.Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3 |
| D.NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性 |
拟用下图装置制取如下表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂)。能达到实验目的的是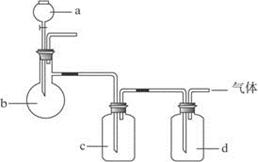
| 选项 |
气体 |
a |
b |
c |
d |
| A |
SO2 |
硫酸 |
亚硫酸钠 |
浓硫酸 |
NaOH溶液 |
| B |
NH3 |
浓氨水 |
消石灰 |
浓硫酸 |
H2O |
| C |
O2 |
双氧水 |
MnO2 |
H2O |
浓硫酸 |
| D |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液无红色出现。若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
| A.0.21 mol | B.0.24 mol | C.0.16 mol | D.0.14 mol |
下列示意图与对应的反应情况正确的是
| A.含0.01molKOH 和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| C.n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物 |
| D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐 |
某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。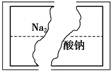
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
| 选项 |
预测物质的化学式 |
检验需要的试剂 |
操作、现象及结论 |
| A |
Na2SO4 |
稀盐酸、氯化钡溶液 |
取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
| B |
Na2CO3 |
稀盐酸、澄清的石灰水 |
取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
| C |
Na2SO3 |
稀盐酸、澄清的石灰水、品红溶液 |
取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
| D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+。现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336 mL。
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336 mL,该气体能使品红溶液褪色。
根据上述实验,下列推断正确的是
| A.K+一定存在 | B.Ag+和Cl-一定不存在 |
| C.HCO3-一定不存在 | D.混合溶液中一定有0.015 mol SO32- |
下列表述正确的是
| A.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol |
| C.将SO2通入Ca(ClO)2溶液中: Ca2++ 2ClO-+ SO2 + H2O=CaSO3↓ + 2 HClO |
| D.在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
试题篮
()