在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
| A.Cu2+和Fe2+ | B.H+ | C.Fe2+ | D.Fe3+和Cu2+ |
恒温恒容时,向体积为2.0L密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/ mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)="0.0016" mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)="0.12" mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
将一定量硫酸、硝酸和KNO3溶液混合成100ml溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L,2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为
| A.11.2 L | B.6.72 L | C.8.96 L | D.4.48 L |
用CH4催化还原NOx可以消除氮氧化物的污染。例如
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);ΔH=-574kJ/mol
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g);ΔH=-1160kJ/mol
下列说法不正确的是
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);ΔH=-Q kJ/mol,Q>574 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48LCH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.6mol |
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法正确的是: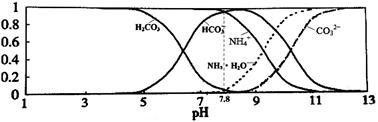
| A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-) |
| B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) |
| C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| D.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3) |
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) =" 0.1" mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是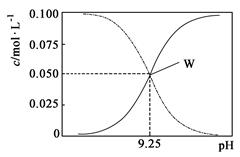
| A.W点表示溶液中:c(NH4+) +c(H+) = c(OH-) |
| B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1 |
| C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+) |
| D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是
| A.H3PO4的Ka3=10–12.2,HPO42–的水解平衡常数为10–6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42–)>c(PO43-)>c(OH-)>c(H+) |
| D.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
某X溶液可使甲基橙呈红色,在该溶液中可能含有K+、Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、AlO2-、SiO32-、C1―中的若干种,现取X溶液进行连续实验,实验过程现象及产物如下,下列说法正确的是
| A.X中肯定存在Fe2+、A13+、NH4+、C1- |
| B.X中不能确定的离子是 K+和C1- |
| C.沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 |
| D.标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
电解法是处理工业废水的一种重要方法。如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理。电解时采用Fe作阳极,惰性电极作阴极。已知:①氧化性:Cr2O72->Fe3+;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31。下列说法正确的是
| A.阳极材料也可以是Cu |
| B.阴极每产生3molH2,则有1mol Cr2O72-被还原 |
| C.一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| D.电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。
CH4、HCOOH、H2的产量和镍粉用量的关系如右图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:
由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是
| A.反应Ⅰ的速率增加,反应Ⅱ的速率不变 |
| B.反应Ⅰ的速率不变,反应Ⅱ的速率增加 |
| C.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 |
| D.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法不正确的
A.a点的溶液呈酸性的原因为:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.c点沉淀的质量比a点沉淀的质量大 |
| C.b点加入Ba(OH)2溶液的体积为150 mL |
| D.至c点完成反应,反应的离子方程式可表示为: |
Al3++2SO42-+NH4++2Ba2++5OH-= AlO2-+2BaSO4↓+NH3·H2O+2H2O
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
| A.若甲既能与盐酸反应又能与NaOH溶液反应则丙可能属于两性氧化物 |
| B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
| C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |
| D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是
| A.该混合气体中一定含有乙烯 |
| B.该混合气体一定含有甲烷和乙炔 |
| C.在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变 |
| D.若混合气体由CH4和C2H4组成,则其体积比为1:3 |
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0. 1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加人过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
IV、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
下列推断不正确的是:
| A.由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ |
| B.Ⅲ中加人盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O |
| C.原溶液一定只含有的离子I-、NO3-,SO42-,Mg2+、Al3+ |
| D.另取1OOmL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4 g |
试题篮
()