下列用数轴表示的产物与量的关系不合理的是( )
| A.铁与稀硝酸反应: |
 |
| B.Cl2与FeI2溶液反应后的产物: |
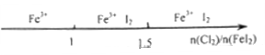 |
| C.向烧碱液中通入SO2后的产物: |
 |
| 向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |
 |
8.34g FeSO4•7H2O(分子量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是( )

| A.温度为78℃时固体物质M的化学式为FeSO4•5H2O |
| B.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4•H2O FeSO4 +H2O FeSO4 +H2O |
| D.温度为l59℃时固体N的化学式为FeSO4•2H2O |
8.34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是( )

| A.温度为78℃时固体物质M的化学式为FeSO4·5H2O |
| B.温度为159℃时固体物质N的化学式为FeSO4·3H2O |
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑ FeO+SO3↑ |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液,所得滴定曲线如图所示.下列说法正确的是( )

| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,若容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1
含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
| A.曲线a表示Fe2+,曲线b表示Fe3+ |
| B.P点时总反应的离子方程式可表示为5Fe+16H++NO3-==3Fe2++2Fe3++4NO↑+8H2O |
| C.n2=0.25 |
| D.n3:n1=3:2 |
已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C有如下关系:
则下列推断不正确的是
A.鉴别A和甲烷可选择使用酸性高锰酸钾溶液
B.乙酸中含有的官能团为羟基
C.C的名称为乙酸乙酯
D.过量饮用B会对人体造成伤害
Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)  。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min |
0 |
20 |
40 |
60 |
80 |
120 |
| x(HI) |
1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
| x(HI) |
0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)  2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 
下列说法不正确的是( )
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 |
| B.2c1<1.5 |
C.在该温度下甲容器中反应的平衡常数K= |
| D.2ρ1=ρ2 |
在标准状况下,将aLNH3完全溶于1L水得到VmL氨水,溶液的密度为ρg∙cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
① ②
② ③
③ ④
④ ⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
| A.①②④ | B.②③④ | C.②④ | D.②③⑤ |
某种混合气体,可能含有N2、HCl、CO,把混合气体依次通过足量的NaHCO3溶液和灼热CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积缩小。最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是( )
| A.一定没有N2;CO和HCl中至少有一种 | B.一定有N2、CO和HCl |
| C.一定有N2;CO和HCl中至少有一种 | D.一定有N2和HCl;没有CO |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.50 mL | C.30 mL | D.15 mL |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

A.该反应的化学方程式为:3X+2Y 2Z 2Z |
| B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 |
| C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
| A.③②①⑤④ | B.③⑤②①④ | C.②③①④⑤ | D.①②③⑤④ |
试题篮
()