在恒容条件下发生反应A(g)+3B(g) 2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是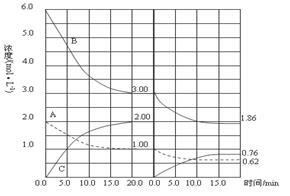
A.第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L·s)
B.第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019
C.第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ﹤KⅡ
D.由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”.工业上以金红石为原料制
取Ti的反应为Ⅰ. aTiO2 + bCl2 + eC  aTiCl4 + eCO
aTiCl4 + eCO
Ⅱ. TiCl4 + 2Mg  Ti + 2MgCl2
Ti + 2MgCl2
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=e=2
⑤每生成19.2g Ti,反应Ⅰ、Ⅱ中共转移4.8mol e﹣.
A.①②④ B.②③④ C.②⑤ D.③④
碘是一种与人的生命活动密切相关的元素,已知I2能溶于NaOH或KI溶液,反应方程式分别为:3I2+6OH﹣═5I﹣+IO3-+3H2O(HIO不稳定,易发生歧化反应)和I2+I﹣═I3-,溴化碘(IBr)是一种卤素互化物,具有与卤素单质相似的性质,下列反应方程式中不正确的是
| A.IBr加入Na2S溶液中产生黄色浑浊:IBr+S2﹣═I﹣+Br﹣+S↓ |
| B.IBr加入KI溶液中:IBr+2I﹣═Br﹣+ I3- |
| C.IBr加入NaOH溶液中:IBr+2OH﹣═BrO﹣+I﹣+H2O |
| D.IBr加入AgNO3溶液中:3IBr+5Ag++3H2O═3AgBr↓+2AgI↓+ IO3-+6H+ |
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定25.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)=10—5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)>c(Y—)>c(OH—)>c(H+) |
D.HY与HZ混合,达到平衡时: |
下列各表述与示意图一致的是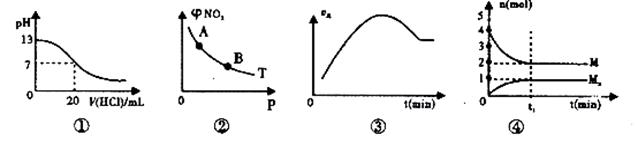
| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
| C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应 2A2(g)+B2(g)  2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时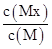 将增大 将增大 |
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.C1:C2=1:3 |
| B.平衡时,H2和NH3的生成速率之比为2:3 |
| C.N2、H2的转化率之比为1:3 |
| D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1 |
某混合液中可能含有下列离子中的若干种:K+、Na+、 Fe2+、Fe3+、SO42―、HCO3―、CO32―。现取三份20 mL该溶液进行如下实验:
① 第一份加入足量稀盐酸,无任何气体产生;
② 第二份加入足量NaOH,经搅拌,过滤,洗涤,灼烧,最后得到x g固体;
③ 第三份滴加0.1 mol·L―1酸性KMnO4溶液,反应至终点,共消耗其体积为V mL;
④ 另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色。
根据上述实验,以下说法正确的是:
| A.由实验①无法推断原混合溶液中是否含有SO42― |
| B.原混合溶液中只存在Na+、 Fe3+、SO42―,不可能存在K+、CO32― |
| C.由实验①、②可判断原混合液中是否含Fe3+ |
| D.由实验③可判断原混合液中存在Fe2+ |
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,正确的是
(甲)AO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
| A.④⑤ | B.①③ | C.②③ | D.①② |
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCI2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是
| A.c(CO32-)=0.01mol•L-1,c(NH4+)>c(SO42-) |
| B.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
| C.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| D.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、k+ |
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是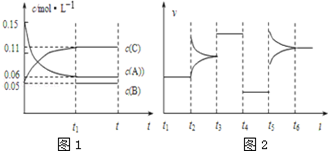
A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol•L﹣1•s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)⇌B(g)+2C(g)
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程:
下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2;控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
| D.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
向Fe(NO3)3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
| 氢氧化物 |
溶液PH |
|||
| 开始沉淀 |
沉淀完全 |
沉淀开始溶解 |
沉淀完全溶解 |
|
| Fe(OH)3 |
2.3 |
3.4 |
— |
— |
| Al(OH)3 |
3.3 |
5.2 |
7.8 |
12.8 |

A.OA段产生的沉淀为BaSO4和Fe(OH)3
B.据图计算原溶液中c(NO3-)=c(SO42-)
C.AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D.C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2- + 2H2O = Al(OH)3 + OH一
有一混合物的水溶液,只可能含以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42 -,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。
根据上述实验回答: ___________, 不能确定是否存在的离子是________________。
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号______,浓度_____________;
离子符号______,浓度_______________;
离子符号______,浓度________________;
(3)试确定K+ 是否存在________(填“是”或“否”),判断的理由是 ______________。
试题篮
()