(本题共14分)金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
57、某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为 。
58、已知2Mg3N2+3CO2 → 3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加 g。
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如下:
| 实验组号 |
① |
② |
③ |
④ |
| 碳化物(g) |
6.2 |
9.3 |
15.5 |
21.7 |
| 水(mL) |
18 |
18 |
18 |
18 |
| 气体(L,标准状况) |
3.36 |
5.04 |
8.4左右 |
8.4左右 |
59、求该混合物中Be2C与CaC2的物质的量之比 。
60、与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(6分)把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:(不必写过程,直接将答案填写在答题卡上)
(1)混合溶液中H+、Cu2+、SO42-的物质的量浓度;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式,并计算残渣的质量(不计操作带来的损失)。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
求:(1)x的值是多少;
(2)B的平均反应速率;
(3)则反应开始前放入容器中A、B的物质的量。
一定质量的某金属 X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个
X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个  Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
5.8g有机物完全燃烧,只生成CO2和H2O蒸气,其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增加18.6g,同量的有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2。(简要写出求算过程)
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)有机物的结构简式 。
摩尔盐[(NH4)aFeb(SO4)c·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)(NH4)aFeb(SO4)c·zH2O中存在a+2b-2c=0,则该物质中铁元素的化合价为 。
(2)③中发生反应的离子方程式为 。
(3)通过计算确定样品中n(NH4+)∶n(H2O)(必须写出计算过程)。
(15分)某研究性学习小组通过测量镁铝合金和盐酸反应生成气体体积的方法来测定合金的成分,他们取10.2 g镁铝合金与盐酸恰好完全反应,反应后收集得11.2 L氢气(已转换成标准状况),试求:
(1)反应过程中消耗盐酸的物质的量
(2)10.2 g合金中镁的质量。(请写出计算过程)
FeS2是Li/FeS2电池的正极活性物质,可用水热法合成。等物质的量的FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)FeS2中硫元素的化合价为;合成FeS2离子方程式为 。
(2)用CS2、H2O洗涤除去杂质,其中用CS2洗涤的目的是 。
(3)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
(10分)某有机物的蒸气密度是相同状况下甲烷密度的3.625倍。把1.16g该有机物在氧气中充分燃烧,将生成的混合物依次通过足量浓硫酸和碱石灰,分别增重1.08g和2.64g,试求该有机物的分子式,要求有一定的答题步骤。
(8分)某烷烃和某单烯烃的混合气体2.24 L(标准状况),使其完全燃烧,产生的气体完全通过浓硫酸,浓硫酸质量增加4.50 g,剩余气体通过碱石灰,碱石灰质量增加了7.70 g,另取该混合气体2.24 L(标准状况),通过足量溴水,溴水质量增加了1.40 g,试通过计算回答:
(1)该混合气体由哪两种烃组成?
(2)该混合气体中两种烃的体积分数分别是多少?
(本题共14分)铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O g,CaO mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2 2Cu+SO2
2Cu+SO2
日均需精辉铜矿 t,日均产SO2标准状况下体积 L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2gCu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式 。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O Cu(NO3)2·3H2O 125g /100g H2O
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中,发生反应:3X(g) + Y(g) ="==" nZ(g) +2W(g) , 5min末已生成0.2 mol W,若测知以Z浓度变化来表示的平均速率为0.01 mol.L-1.min-1.计算:
(1)n的值为
(2)前5 min内用X表示的反应速率
(3)5 min末Y的浓度
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为 。
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)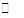 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率
试题篮
()