(1)将一束灼热的细铜丝立刻放进盛有氯气的集气瓶中,产生的现象是 ,反应的方程式是 。若将一束擦亮的细铜丝伸进装有硫蒸气的大试管内,产生的现象是 ,反应的方程式是 ,由此得出Cl2与S的氧化性比较是 。
(2)某学生在做铜丝在硫蒸气中燃烧的实验时,先将铜丝用砂纸磨光,在酒精灯上预热后迅速插入试管内靠近熔化的硫的液面上方,结果未见铜丝燃烧。实验失败的可能原因是:① ,② 。
(3)汞蒸气有毒。①万一把汞洒出,可以在溅洒有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是: 。②室内有汞蒸气时,应进行通风以降低汞蒸气浓度,这时通风口装在墙的 (填“上”或“下”)部的效率高。
(4)举出两个实验事实,说明氧的非金属性比氟弱:① ;② 。
某化学兴趣小组对过量炭粉与氧化铁反应产物中气体的成分进行研究。
(1)假设该反应的气体产物全部是二氧化碳。
(2)设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与炭、氧化铁发生反应,可用来隔绝氧气。
(4)实验:
| 操作步骤和实验现象 |
简答 |
| ①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按上图装置连接 |
①写出装置中编号仪器的名称: A__________,B__________ |
| ②加热前,先通入一定量纯净、干燥的氮气 |
②其目的是_______________ |
| ③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 |
③该现象说明__________ |
| ④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24 g |
— |
(5)数据处理:经计算,参加反应的碳元素质量为_________g,氧元素质量为____________g。
(6)结论:根据数据处理结果,得出原假设不成立,理由是_____________________________。
课题式课堂教学是研究性学习的一种重要方式,其基本教学模式为:提出课题→确定研究方案→解决问题→总结和评价。
下面是关于“CO的化学性质”的课题式课堂教学中解决问题阶段:甲同学设计的证明CO具有还原性的实验装置,如图所示。完成下列有关问题:
(1)点燃酒精灯A、B的顺序是_______。
(2)硬质管中发生反应的化学方程式为_____________________。
(3)洗气瓶中的实验现象为_______________________________。
(4)酒精灯B的作用_____________________________________。
(5)乙同学提出甲同学装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导气管出口旋转到A的火焰上即可,乙同学的设计是否合理?简述理由。
要分离CO、CO2并分别得到干燥的气体,某学生设计了如图装置,其中a是铁夹,b是分液漏斗玻璃活塞。
(1)甲容器中盛_______溶液,乙容器中盛_______溶液,丙容器盛_______溶液。
(2)实验时关闭_______ (a、b),打开_______ (a、b),发生反应的化学方程式是_______,这样得到的气体是_______。
(3)当分离完一种气体后,关闭_______ (a、b),打开_______ (a,b),发生反应的化学方程式是______________,这样得到的气体是_______。
某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:
| 氧化物 |
CaO |
Al2O3 |
SiO2 |
H2O |
| 质量分数 |
0.142 0 |
0.260 2 |
0.459 2 |
0.137 8 |

请你通过计算,写出该硅酸盐的普通化学式和氧化物表示式。
(1)普通化学式为_____________________________________________________;
(2)氧化物表示为_____________________________________________________。
Ⅱ.如右图所示,装有萌发种子的广口瓶,过一段时间,往广口瓶里注入清水,试管里的现象是_____________________________________________________,有关的反应方程式为___________________________。
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用图Ⅰ所示的装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O====NaAlO2+NH3↑,已知NH3极易溶解于水,Al在常温下能与NaOH溶液反应:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
图Ⅰ
(1)实验有关操作为:
a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体
b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液
c.检验装置的气密性
d.读取收集到水的体积
正确的操作顺序为______________________。
(2)本实验中检查装置气密性的方法是________________________。
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
| A.丁烷 | B.酒精 | C.植物油 | D.CCl4 |
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为___________(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是__________________________。
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?________________(填“可行”或“不可行”)。理由是________________________。
图Ⅱ
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。

Ⅰ.用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂____________________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式______________________________。
装置C中NaOH溶液的作用是____________________________________________。
(3)你认为该装置是否有不足之处?__________。如果有,请一一说明____________________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si。
②Mg在点燃的条件下即可与SiO2反应。
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应。
⑤SiH4在空气中自燃。
他们在研究报告中记载着:“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……再用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右。”
(4)该小组“实验室制Si”的化学方程式是__________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是___________________。
用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________________________________。
(2)除去蒸馏水中溶解的O2常采用的方法是_______________________________________。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____________________________________
_______________________________________________________________________________。
方法二:在如下图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是___________________。
(2)在试管Ⅱ里加入的试剂是___________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_______________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________
_______________________________________________________________________________。
右图中所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
(1)C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为___________________
______________________________________________________________________________。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯,橡胶气胆B在实验中的作用是______________________________________________________________________________。
(3)C中全部反应产物有______________、______________、______________。(填化学式)
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:800 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19 g·mol-1)、水。按如图所示装置进行实验,完成下列问题(设合金样品完全反应,产生的气体体积不超过100 mL)。
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称最后的合金样品用铜网小心包裹好,放在100 mL烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是:_____________。
有一无色溶液,可能含有 、
、 、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如下图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: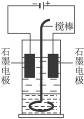
(1)阳极上的电极反应式为___________________________________。
(2)阴极上的电极反应式为___________________________________。
(3)原上层液体是___________________________________________。
(4)原下层液体是___________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是___________________________________,现象是________________________________________。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图418。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: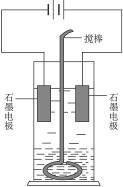
图4-18
(1)阳极上的电极反应式为_______________________。
(2)阴极上的电极反应式为_______________________。
(3)原上层液体是______________________。
(4)原下层液体是______________________。
(5)搅拌后两层液体颜色发生变化的原因是_______________________。
(6)要检验上层液体中含有的金属离子,其方法是_______________,现象是_______________。
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下: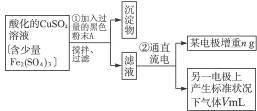

图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
| A.称量电解前电极的质量 |
| B.电解后电极在烘干、称量前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上的铜,并清洗、称量 |
| D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次 |
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:氧化型(蓝色)+ne- 还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。
还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。
图1 图2
某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2 g NaOH、100 mL H2O和2 g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从____________导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液_________(填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是_________试管。
(3)上述转化过程中葡萄糖的作用是_________,亚甲基蓝的作用是_________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为____________________________________。
(5)该实验中③④操作_________(填“能”或“不能”)无限次重复进行,理由是______________。
试题篮
()