已知反应:2H2CrO4 + 3H2O2=2Cr(OH)3 + 3O2↑+ 2H2O,该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)用单线桥法表示反应中电子转移的方向和数目:2H2CrO4 + 3H2O2=2Cr(OH)3 + 3O2↑+ 2H2O。
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为
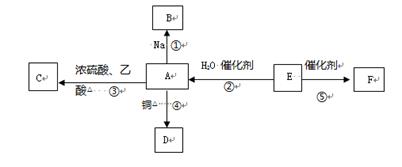
根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ;②的反应类型是 。
(3)反应④的化学方程式是 。
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液应称取NaOH的质量是 克。
除量筒、烧杯、玻璃棒、胶头滴管外还需要的其它仪器是 。
(2)容量瓶上需标有以下五项中的 ;
① 温度 ② 浓度 ③ 容量 ④ 压强 ⑤ 刻度线
(3)下列配制的溶液浓度偏低的是 ;
| A.定容时俯视刻度线 |
| B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面 |
| C.加蒸馏水时不慎超过了刻度线 |
| D.配制前,容量瓶中有少量蒸馏水 |
已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
(1)按要求写出下列反应的离子方程式:
① 少量二氧化碳通入澄清石灰水 。
② 硫酸氢钠与过量氢氧化钡溶液混合 。
③ 熔融状态下NaHSO4电离方程式 。
(2)①用双线桥表示下列氧化还原反应电子转移:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②配平下面方程式:
KMnO4+ H2O2+ H2SO4 — K2SO4 + MnSO4 + O2↑+ H2O
(框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。

请填写下列空白:
(1)写出化学式:A ,B ,D 。
(2)以上反应中,属于氧化还原反应的有 (填编号)。
(3)写出E D的化学方程式: 。
D的化学方程式: 。
有以下一系列反应,最终产物为草酸。已知B的相对分子质量比A的大79。
试回答下列问题:
(1)B的结构简式为__________, B→C的反应类型__________;
E→F的化学方程式:____________________________________________________。
(2)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是(请用“>”将四种物质的化学式连接起来表示)________________________________________________。
(3)MTBE是一种重要的汽油添加剂,它是1-戊醇的同分异构体,又与G的某种同分异构体互为同系物,且分子中含有四个相同的烃基。则MTBE的结构简式为_________,它的同类别同分异构体有___________种(包括它本身)。
E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。
(1)请写出E的电子式 。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②: ,反应类型 。
反应④: ,反应类型 。
反应⑤: ,反应类型 。
(3)比较反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度。
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:

已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式 。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式 。
(3)写出铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5) D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)。
(7)Al与NO3-在酸性条件下反应生成气体C,Al与被还原的NO3-的物质的量之比是 。
化合物 是鞘氨醇激酶抑制剂,其合成路线如图:
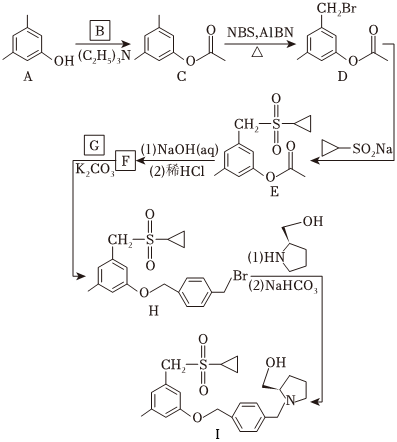
(1)化合物A的酸性比环己醇的_____(填“强”或“弱”或“无差别”)。
(2)B的分子式为 ,可由乙酸与 反应合成,B的结构简式为_____。
(3)A→C中加入 是为了结构反应中产生的_____(填化学式)。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:_____。碱性条件水解后酸化生成两种产物,产物之一的分子中碳原子轨道杂化类型相同且室温下不能使 酸性 溶液褪色;加热条件下,铜催化另一产物与氧气反应,所得有机产物的核磁共振氢谱中只有 个峰。
(5)G的分子式为 ,F→H的反应类型为_____。
(6)写出以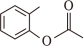 、
、 和
为原料制备
和
为原料制备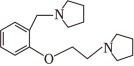 的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
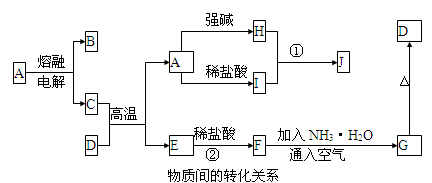
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
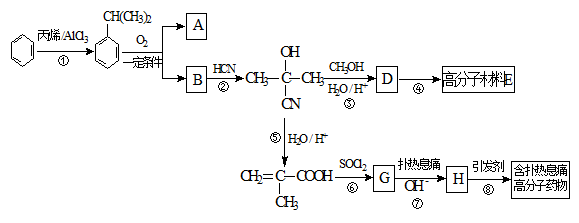
高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
已知:I.含扑热息痛高分子药物的结构为: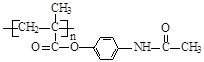 。
。
II.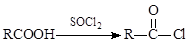
III.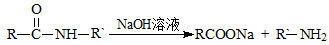
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol  可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式 。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
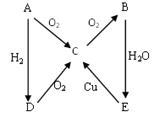
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
A、B、C、D、E为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E处于同一周期,E原子的最外层电子数是A、B、C原子最外层电子数之和,D是地壳中含量最高的金属元素;A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝;E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),25℃时0.1 mol/L的乙溶液pH>l;D的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐丁,也能与丙的水溶液反应生成盐。
请回答下列问题:
(1)甲的化学式为 ;B单质的电子式为 。
(2)D元素的名称是 。
(3)写出丁溶液中通入过量二氧化碳时的离子方程式
(4)工业上利用A、B的单质合成甲(BA3):B2 (g)+3A2 (g)  2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
(5)E的单质与甲反应生成的乙和丙的物质的量之比为2:4.反应中被氧化的物质与被还原的物质的物质的量之比为 。
试题篮
()