X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
[化学——选修5:有机化学基础]
有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:

已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,且峰面积之比为1︰2︰2︰1。②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③
回答以下问题:
(1)A中含有的官能团名称是 。
(2)写出有机反应类型B→C ,F→G 。
(3)写出F生成G的化学方程式
(4)写出J的结构简式
(5)E的同分异构体有多种,写出其中一种符合以下要求的E的同分异构体的结构简式
①与FeCl3溶液发生显色反应 ②能发生银镜反应
③苯环上只有两个对位取代基 ④能发生水解反应
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
奈必洛尔是一种用于血管扩张的降血压药物。用于合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为
请回答下列问题:
(1)G物质中的含氧官能团的名称是 、 。
(2)反应A→B的化学方程式为 。
(3)上述④、⑤变化过程的反应类型分别是 、 。
(4)写出满足下列条件的C的一种同分异构体的结构简式:
Ⅰ.苯环上只有两种取代基。
Ⅱ.分子中只有4种不同化学环境的氢。
Ⅲ.能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以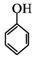 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路
的合成路
线流程图(无机试剂任选)。合成路线流程图示例如下:
下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。

根据图示回答问题:
(1)按要求写出下列化学用语:若B原子中子数比质子数多1,则B的原子符号为 ;C的电子式为 ,若D最外层只有两个电子,则D的原子结构示意图 ;
(2)写出反应①的化学方程式是 ;写出反应②的化学方程式并标出电子转移的方向和数目__________________
(3)J与稀硝酸反应的离子方程式是 ;用排水法收集满该反应的还原产物后,将试管倒扣在水槽中并通入O2使试管刚好全部充满水,假设液体不外溢,则所得溶液的物质的量浓度为 。
A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式为           。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式               。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是                           。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色单质,且产物对大气无污染,其化学反应方程式是                             。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为                                                       。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式              ;若0.1 mol该化合物完全反应,转移电子的物质的量为             。
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:

①反应C+G  B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I  2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为______________________________;
(2)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉__________克;
(3)C与过量NaOH溶液反应的离子方程式为________________________________,
反应后的溶液与过量的化合物I反应的离子方程式为_______________________;
(4)E与I反应的化学方程式为______________________________;
(5)写出H物质在工业上的一种用途___________________;
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为______。
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
[化学—选修5:有机化学基础]化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
② 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的化学名称_____________________;
(2)B的结构简式为_____________________;
(3)D生成E的化学方程式为_____________________,该反应类型为______________;
(4)F的结构简式为______________;
(5)H在一定条件下反应生成高聚物的化学方程式为______________;
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有_______种(不考虑立体异构)。G的一个同分异构体被酸性高锰酸钾溶液氧化后核磁共振氢谱为两组峰,且峰面积比为2:1,写出G的这种同分异构体的结构简式为________。
A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
| B |
|
|
| |
|
F |
(1)BF2的结构式为____________。
(2)D和F的氢化物中沸点较高的是_________(填化学式)。
(3)实验室制取G2气体的离子方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为___________________________________________________。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为_______________________.
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________。
【化学—选修5:有机化学基础】
对乙酰氨基苯酚M( )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等。M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等。M的一种合成路线如下:
已知:①X、Y、T分子的核碰共振氢谱只显示1组峰,且X能使溴水褪色;
② 。
。
(1)X、Y的结构简式为______________、_____________________;
(2)Ⅲ的反应类型为_______________,Ⅵ的反应方程式为________________;
(3)M与足量氢氧化钠溶液反应的化学方程式为______________________________;
(4)M有多种同分异构体,其中一类与J互为同系物且氮原子与苯环直接相连,此类同分异构体共有_____种;另一类同分异构体同时满足下列条件①属于对位二取代苯且苯环上连有—NH2;②能发生水解反应;③核碰共振氢谱有4组峰。写出其中一种同分异构体的结构简式_________________。
【化学—选修2:物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为________;
(2)单质A有两种同素异形体,其中沸点高的是________(填分子式),原因是________;A和B的氢化物所属的晶体类型分别为______和_______;
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为________,中心原子的杂化轨道类型_______;
(4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________,晶胞中A原子的配位数为_______;列式计算晶体F的密度_______。
酸牛奶是人们喜爱的一种营养饮料。酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖。酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为: 。工业上它可由乙烯来合成,方法如下:
。工业上它可由乙烯来合成,方法如下:

(1)D的结构简式 ,所含的官能团的名称是 。
(2)写出下列转化的化学方程式:
①A的生成 。
②C的生成 。
③B的生成 。
④D→E 。
菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如下:

已知:

(1)A的结构简式为 , G物质核磁共振氢谱共有 个峰。
(2)写出F和G反应生成H的化学方程式 。写出D生成E的化学方程式 。
(3) 呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: 。
呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: 。
①环上的一氯代物只有一种 ②含有酯基 ③能发生银镜反应
(4)结合题给信息,以溴乙烷和环氧乙烷为原料制备1-丁醇,设计合成路线(其他试剂任选)。合成路线流程图示例:

合成路线:________________________________________
一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
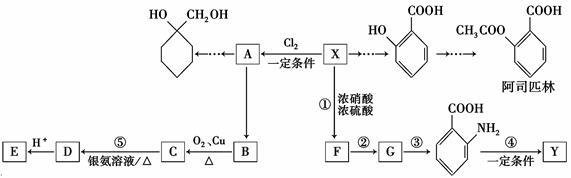
已知:
①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:

③ (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为______________,其侧链氢原子全部被苯环取代后,最多有 个碳原子共面;(2) 的名称为____________________,G中官能团名称为___________;
的名称为____________________,G中官能团名称为___________;
(3)反应③的反应类型是________;已知A为一氯代物,则E的结构简式是____________;(4)反应④的化学方程式为__________________________________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有________种:
①含有苯环;
②既不能发生水解反应,也不能发生银镜反应;
③1 mol该有机物能与2 molNaHCO3完全反应。
(6)参照上述合成路线,结合所学知识,设计一条以A为原料制备 的合成路线(无机试剂任用)。合成路线流程图示例如下:
的合成路线(无机试剂任用)。合成路线流程图示例如下:
 。
。
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是__________。
(2)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=________(用含有a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____________________________________。
(4)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.001 25 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________。
试题篮
()