A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,右图是它们之间的相互转化关系。请回答: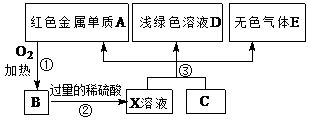
(1)反应①的基本反应类型是 ;
(2)C的化学式为 ;
(3)写出反应②的离子方程式 。
(4)A和稀硫酸、双氧水生成X的化学方程式 。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。请回答下列问题:
(1) X、Y、Z、W四种元素的原子半径由大到小的排列顺序是_______ (用元素符号表示)。
(2) 由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 _______。
(3) 由X、Y、Z、W四种元素组成的一种离子化合物A:
①已知1 mol A能与足量的NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式_______ ;
②又知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式_______;
(4) 由X,Y,Z,W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。 过一段时间白色沉淀变成灰绿色,最终变成红褐色;b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①B的化学式为_______
②B溶液中的离子浓度由大到小的顺序为:_______
已知常温下A是黄绿色气体,C是淡黄色固体,E为红褐色胶体。在合适的反应条 件下,他们可以按下图进行反应: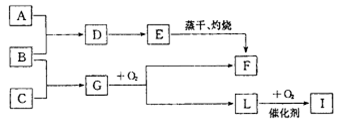
(1) 上图F物质的化学式________
(2) 简要写出由D制备E胶体的实验操作过程_______。
(3) 写出B+ C→G在一定条件下发生的化学反应方程式_______
(4) 写出B在潮湿的空气中发生电化学腐蚀时,正极的电极反应式:_______
(5) 在一定温度下, 。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。
。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。
下方图中A~K均为中学化学中常见的物质,其中A和F是金属单质,D是最常见的溶剂。I为黄绿色气体,C的焰色反应呈黄色,K是红褐色固体。
(1)A元素在周期表中位于第 周期 族 。
(2)G+I→H的离子方程式为 。
(4)如上方右图所示,F处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,该金属被腐蚀的速率由快到慢的顺序是(填序号)_______________。
A、B、C、D为常见气体单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子。
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请回答:
(1)C和D反应生成的化合物的电子式是 。
(2)上述②中化合物的热稳定性 强于 。(填写化学式)
(3)将D通入B、C生成的化合物中,发生反应的化学方程式为 。
1.下图是合成某种聚酯纤维H的流程图:
已知:A、D为烃,质谱图表明G的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧;G能与NaHCO3溶液反应且含有苯环;核磁共振氢谱表明E、G分子中均有两种类型的氢原子,且E分子中两种类型的氢原子的个数比为1:1。
(1)①、⑤的反应类型依次为 、 ;
(2)B的名称为: ;F的结构简式为: ;
(3)写出下列化学方程式:
②
③
⑥
(4)F有多种同分异构体,写出同时符合下列条件的任意一种同分异构体的结构简式
a.含有苯环且苯环上只有2个取代基
b.能与NaOH溶液反应
c.在Cu催化下与O2反应的产物能发生银镜反应
2.2-氯-1,3-丁二烯(  )是制备氯丁橡胶的原料。由于双键上的氢原子很难发
)是制备氯丁橡胶的原料。由于双键上的氢原子很难发
生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应制得。下面是2-氯-1,3-丁二烯的合成路线:
写出A、B的结构简式(用键线式表示):A ,B
物质A为生活中常见的有机物,只含有C、H、O三种元素,且它们的质量比为12∶3∶8。物质D是一种芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题。
已知,两分子醛在一定条件下可以发生如下反应(其中R、R′为H或烃基):
(1) 写出物质A的结构简式: ____;C的名称: ______;E中含氧官能团的名称:_______。
(2) 写出下列反应的有机反应类型:A→B____________________; E→F____________________
(3) 写出H与G反应生成I的化学方程式: ___________________________________________。
(4) 写出D与新制氢氧化铜反应的化学方程式:
____________________________________________________________________。
(5) 若F与NaOH溶液发生反应,则1 mol F最多消耗NaOH的物质的量为_____mol。
(6) E有多种同分异构体,与E具有相同官能团的芳香族同分异构体有________种(包括本身和顺反异构),写出其中核磁共振氢谱有五个吸收峰的同分异构体的结构简式:
____________________________________________________________________。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第 周期 族。
(2)电解X溶液的离子方程式: 。
(3)D + E → B的反应中,被氧化与被还原的物质的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
已知A是用途最广泛的金属单质,B是常温下呈液态的化合物,E是一种黄绿色的气体。(图中部分产物未标出)。 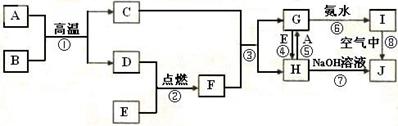
回答下列问题:
(1)写出C的化学式 ,写出反应①的化学反应方程式: 。
(2)写出反应③的离子方程式
写出反应④的离子方程式________________________________________
(3)鉴别G溶液中阳离子的方法 。
(4)将H溶液滴加到沸水中,继续加热煮沸,得到的溶液颜色为_________
分散质的大小在___________________.
芳香化合物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A制得某药物H的转化关系如图所示(由A→G,G→H的反应条件和部分反应物已略去)。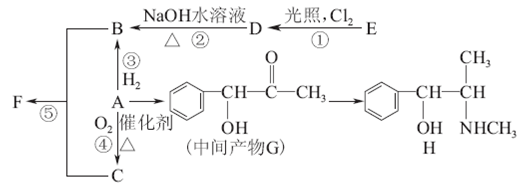
请回答下列问题:
(1)有机物A的相对分子质量为106,A中所含碳氢氧三种元素的质量比为42∶3∶8,A的结构简式为 ,检验A中含氧官能团的方法是 。
(2)关于药物H的下列说法中正确的是 (填字母)。
a.H的分子式为C10H15NO
b.该物质核磁共振氢谱图中有8个峰
c.属于芳香烃
d.能发生加成、消去、氧化反应
(3)写出D→B的化学方程式 。
(4)反应 ①~⑤属于取代反应的是 (填序号)。
(5)B和C生成F的化学方程式为 。
(6)写出符合下列条件的G的同分异构体的结构简式 。
①既能发生消去反应,又能发生酯化反应
②苯环上的一氯取代物只有两种,分子结构中没有甲基
③能发生银镜反应
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。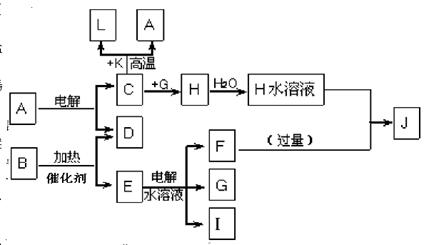
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 ,电解后为使溶液与电解前完全相同,需向上述溶液中通入
(4)J与H反应的离子方程式为
下图是一些常见单质、化合物之间的转化关系图。有些反应中的部分物质及反应条件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,I和K的组成元素相同,I在常温下是无色有毒气体,J是黑色粉末,G是一种红色金属单质。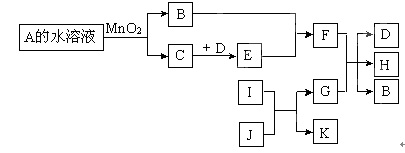
(1)A的化学式是 。 (2)B的电子式是 。
(3)I和J反应的化学方程式为 。
(4)若D是无色气体,且常温下遇空气变为红棕色气体,则G和F反应的离子方程式为
。
现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图: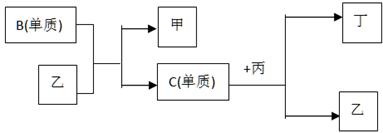
(1)写出B+乙→甲+C的化学反应方程式________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_____。(填写序号)
① A ② B ③ C ④ D
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置 。
B.写出C+丙→乙+丁的化学反应方程式 。
A、B、C、D、E各物质的转化关系如右图所示。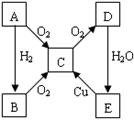
(1)当A为固体单质时,A是 (写化学式)。
①写出B的电子式: ;
②写出E与木炭反应化学方程式: 。
(2)当A为气体单质时,A是 (写化学式)。
①写出B的结构式: ;
写出下列反应的化学方程式,并回答有关问题:
②E→C: ;
③实验室制备B: 。
能不能用浓硫酸做B的干燥剂? (填“能”或“不能”)。
一般情况下,当人体一次性摄取300 mg~500 mg亚硝酸钠时,就会引起中毒.某研究小组用碘量法测定泡菜中亚硝酸盐的含量.有关反应如下:
2NaNO2+2H2SO4+2KI===2NO↑+I2+K2SO4+Na2SO4+2H2O
2Na2S2O3+I2===Na2S4O6+2NaI
取1 kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使泡菜汁中的亚硝酸盐都成为亚硝酸钠.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1 L,取25.00 mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,再选用合适的指示剂,用0.05000 mol·L-1Na2S2O3标准溶液进行滴定.实验数据记录如下:
| 滴定次数 |
0.050 00 mol·L-1 Na2S2O3标准溶液体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
|
| 1 |
0.00 |
20.04 |
| 2 |
0.12 |
20.08 |
| 3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是________,滴定终点的现象是________.
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害.这主要是因为橙汁中含有丰富的维生素C,维生素C具有________性(填“氧化”或“还原”).
(3)通过计算判断若某人一次食入0.125 kg这种泡菜,是否会引起中毒?
试题篮
()