[化学——选修5:有机化学基础]利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为:
BAD的合成路线如下:
试回答下列问题:
(1)写出结构简式Y D 。
(2)属于加成反应的有(填数字序号) 。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出方程式反应④ 。
F+E 。
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应
②遇FeCl3溶液显紫色
③核磁共振氢谱图中有四个吸收峰
(本题共10分)
已知:R-CH=CH-O-R′  R-CH2CHO + R′OH(烃基烯基醚)
R-CH2CHO + R′OH(烃基烯基醚)
烃基烯基醚A的分子式为C12H16O。与A相关的反应如下:
完成下列填空:
43、写出A的结构简式 。
44、写出C→D化学方程式 。
45、写出一种满足下列条件的F的同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应;
②光照时与氯气反应所得的一氯取代产物不能发生消除反应 ;
③分子中有4种不同化学环境的氢原子。
46、设计一条由E合成对甲基苯乙炔( )的合成路线。
)的合成路线。
(无机试剂任选)。合成路线流程图示例如下:
氯吡格雷(clopidogrel)是一种用于抑制血小板聚集的药物。以芳香族化合物A为原料合成的路线如下:

45.写出反应C→D的化学方程式 ,反应类型 。
46.写出结构简式。B ,X 。
47.A属于芳香族化合物的同分异构体(含A)共有 种,写出其中与A不同类别的一种同分异构体的结构简式 。
48.两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式 。
49.已知: ,设计一条由乙烯、甲醇为有机原料制备化合物
,设计一条由乙烯、甲醇为有机原料制备化合物 的合成路线流程图,无机试剂任选。(合成路线常用的表示方式为:
的合成路线流程图,无机试剂任选。(合成路线常用的表示方式为: )
)
肉桂酸甲酯M,常用作调制具有草莓、葡萄、樱桃等香味的食用香精。M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1。
⑴肉桂酸甲酯的结构简式是 。
⑵G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单链或双键)。G的结构简式为 。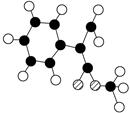
⑶以芳香烃A为原料合成G的路线如下: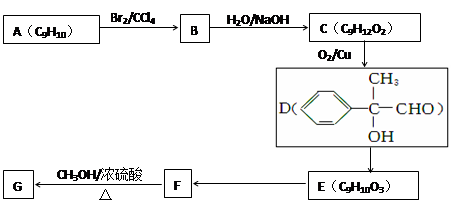
①化合物E中的含氧官能团有________(填名称)。
②E→F的反应类型是__________,F→G的化学方程式为__________________ ____。
③符合下列条件的F的同分异构体有_____种,其中能与银氨溶液反应,且1mol该有机物与析出的银的物质的量之比为1∶4的是 (写结构简式),其中核磁共振氢谱图中有6个峰,且峰面积之比为1∶1∶1∶1∶2∶2的是 (写结构简式)。
Ⅰ.分子内含苯环,且苯环上只有一个支链;不含“―O―O―”和“―C≡C―”;
Ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;
Ⅲ.它不能发生水解反应,不能发生酯化反应。
根据图示填空
(1)化合物A中含有的官能团是 。(填名称)
(2)1mol A与2mo H2反应生成1moE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 ;由E生成F的反应类型是 。
可降解聚合物P的制取路线如下

iii. (还原)其中-NH2基团可以在一定条件下生成-OH基团
(还原)其中-NH2基团可以在一定条件下生成-OH基团
(1)A的含氧官能团名称是_______________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是________________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是 。
(5)E→F中反应①和②的反应类型分别是______________、_______________。
(6)F的结构简式是______________。
(7)聚合物P的结构简式是 。
有机物A分子组成为C4H9Br,分子中有一个甲基支链,在一定条件下A发生如下转化: 已知:①不对称烯烃与HBr加成反应时,一般是Br加在含氢较少的碳原子上,如:
已知:①不对称烯烃与HBr加成反应时,一般是Br加在含氢较少的碳原子上,如:
②连接羟基的碳原子上没有氢原子的醇如:  不能发生催化氧化反应。
不能发生催化氧化反应。
(1)A的结构简式为 B—H中,与A互为同分异构体的有机物是 (填字母代号)
(2)上述转化中属于取代反应的有 (填序号)
(3)C的结构简式为
(4)写出反应④的化学方程式 ,
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
| |
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
| |
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
(1)上表中元素⑨对应的二价阳离子未成对电子数目为______________。
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为 。
(3)元素⑦与①⑤形成的化合物的化学键类型有_________ __________;根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因____________。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
| |
J |
|
|
|
| |
|
|
R |
|
(2)J和氢组成的化合物分子有6个原子,其结构简式为_______________。
(3)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
| 选项 |
a |
b |
c |
d |
| x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
| y |
平衡常数K |
甲的物质的量 |
甲的转化率 |
生成物物质的量总和 |
(4)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为:
______________________________________________________________。
(5)用等式表示R的氢化物与NaOH溶液反应后生 成正盐的溶液中所有离子浓度之间的关系。_____________________
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、D是金属单质,L为红褐色沉淀,E为食盐的主要成分,I的水溶液呈强酸性。
(1)写出反应①的化学方程式:______________________________________。
(2)写出反应②的离子方程式:______________________________________。
(3)向M溶液中加入足量的I溶液反应的离子方程式为______________________。
(4)写出一个由化合反应生成L的化学方程式______________________________。
(
)是基本有机化工原料。由
制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:
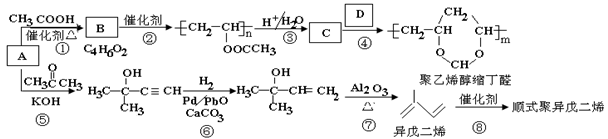
回答下列问题:
(1)
的名称是,B含有的官能团是。
(2)①的反应类型是,⑦的反应类型是。
(3)
和
的结构简式分别为、。
(4)异戊二烯分子中最多有个原子共平面,顺式聚异戊二烯的结构简式为。
(5)写出与
具有相同官能团的异戊二烯的所有同分异构体(填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由
和乙醛为起始原料制备1,3-丁二烯的合成路线。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出气体丙的电子式
(2)写出反应①的化学方程式
反应③的离子方程式:
反应⑤的离子方程式:
(3)若在F溶液中加入D溶液,并露置于空气中,能观察到的现象是 。
聚戊二酸丙二醇酯()是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。
的一种合成路线如下:
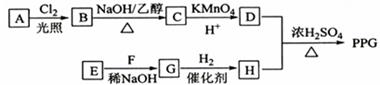
已知:
①烃的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物为单氯代烃:化合物
的分子式为
;
③为相对分子质量差14的同系物,
是福尔马林的溶质;
④ 。
。
回答下列问题:
(1)的结构简式为。
(2)由生成
的化学方程式为。
(3)由和
生成
的反应类型为,
的化学名称为。
(4)①由和H生成
的化学方程式为。
②若平均相对分子质量为10000,则其平均聚合度约为(填标号)。
a.48 b.58 c.76 d.122
(5)的同分异构体中能同时满足下列条件的共有种(不含立体异构):
①能与饱和溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是(写结构简式):
的所有同分异构体在下列-种表征仪器中显示的信号(或数据)完全相同,该仪器是(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:
已知:
根据以上信息,回答下列问题:
(1)B的结构简式为 ,条件I、II中均需要的试剂为 。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有 个。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出下列转化的化学方程式
F→E ;
F→G
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
4 |
9.0 |
6.7 |
(1) 最适合作氧化剂X的是__________,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________。
(3)加入的物质Y是___(写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有_______。
试题篮
()