下列玻璃仪器在相应实验中选用不合理的是( )

| A. |
重结晶法提纯苯甲酸:①②③ |
| B. |
蒸馏法分离 CH2Cl2和 CCl4:③⑤⑥ |
| C. |
浓硫酸催化乙醇制备乙烯:③⑤ |
| D. |
酸碱滴定法测定 NaOH溶液浓度:④⑥ |
下列化学用语表述错误的是( )
| A. |
HClO的电子式: |
| B. |
中子数为
10的氧原子: |
| C. |
NH3分子的
VSEPR模型: |
| D. |
基态
N原子的价层电子排布图: |
中华文化源远流长,化学与文化传承密不可分。下列说法错误的是( )
| A. |
青铜器“四羊方尊”的主要材质为合金 |
| B. |
长沙走马楼出土的竹木简牍主要成分是纤维素 |
| C. |
蔡伦采用碱液蒸煮制浆法造纸,该过程不涉及化学变化 |
| D. |
铜官窑彩瓷是以黏土为主要原料,经高温烧结而成 |
加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如图。
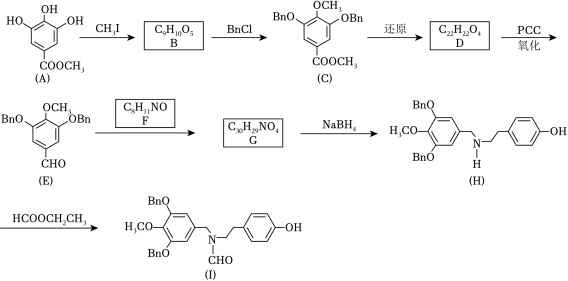
已知:①
Bn为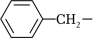
②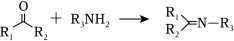 (
R1为烃基,
R2、R3为烃基或
H)
(
R1为烃基,
R2、R3为烃基或
H)
回答下列问题:
(1)A中与卤代烃成醚活性高的羟基位于酯基的_____位(填“间”或“对”)。
(2)C发生酸性水解,新产生的官能团为羟基和_____(填名称)。
(3)用 O2代替 PCC完成D→E的转化,化学方程式为_____。
(4)F的同分异构体中,红外光谱显示有酚羟基、无 N﹣H键的共有_____种。
(5)H→I的反应类型为_____。
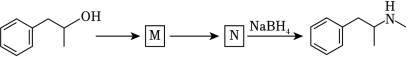
(6)某药物中间体的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为_____和_____。
硫酸工业在国民经济中占有重要地位。
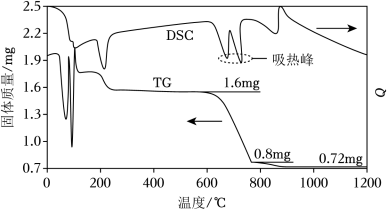
(1)我国古籍记载了硫酸的制备方法——“炼石胆( CuSO4•5H2O)取精华法”。借助现代仪器分析,该制备过程中 CuSO4•5H2O分解的TG曲线(热重)及 DSC曲线(反映体系热量变化情况,数值已省略)如图所示。 700℃左右有两个吸热峰,则此时分解生成的氧化物有 SO2、_____和_____(填化学式)。
(2)铅室法使用了大容积铅室制备硫酸( 76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O═NO+H2SO4ㅤ
2NO+O2═2NO2
(i)上述过程中 NO2的作用为_____。
(ii)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是__________(答出两点即可)。
(3)接触法制硫酸的关键反应为 SO2的催化氧化: SO2(g)+12O2(g)⇌SO3(g)ΔH=﹣98.9kJ•mol﹣1
(i)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率( α)下反应速率(数值已略去)与温度的关系如图所示,下列说法正确的是_____。
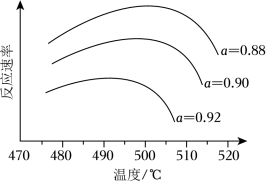
| A. |
温度越高,反应速率越大 |
| B. |
α=0.88的曲线代表平衡转化率 |
| C. |
α越大,反应速率最大值对应温度越低 |
| D. |
可根据不同 α下的最大速率,选择最佳生产温度 |
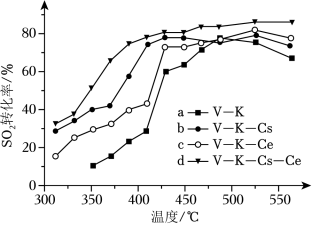
(ii)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_____(填标号)。
(iii)设 O2的平衡分压为 p, SO2的平衡转化率为 α0,用含 p和 α0的代数式表示上述催化氧化反应的 Kp=_____(用平衡分压代替平衡浓度计算)。
2﹣噻吩乙醇( Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如图:

Ⅰ.制钠砂。向烧瓶中加入 300mL液体A和 4.60g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 10℃,加入 25mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 ﹣10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应 30min。
Ⅳ.水解。恢复室温,加入 70mL水,搅拌 30min;加盐酸调 pH至 4~6,继续反应 2h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品 17.92g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择__________。
| A. |
乙醇 |
| B. |
水 |
| C. |
甲苯 |
| D. |
液氨 |
(2)噻吩沸点低于吡咯(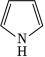 )的原因是__________。
)的原因是__________。
(3)步骤Ⅱ的化学方程式为__________。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是__________。
(5)步骤Ⅳ中用盐酸调节 pH的目的是__________。
(6)下列仪器在步骤Ⅴ中无需使用的是__________(填名称);无水 MgSO4的作用为__________。

(7)产品的产率为__________(用 Na计算,精确至 0.1%)
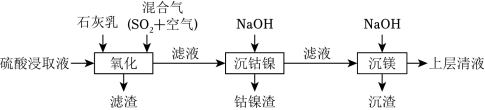
某工厂采用如图工艺处理镍钴矿硫酸浸取液(含 Ni2+、Co2+、Fe2+、Fe3+、Mg2+和 Mn2+)。实现镍、钴、镁元素的回收。
已知:
|
物质 |
Fe(OH)3 |
Co(OH)2 |
Ni(OH)2 |
Mg(OH)2 |
|
Ksp |
10﹣37.4 |
10﹣14.7 |
10﹣14.7 |
10﹣10.8 |
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 __________(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( H2SO5), 1molH2SO5中过氧键的数目为__________。
(3)“氧化”中,用石灰乳调节 pH=4, Mn2+被 H2SO5氧化为 MnO2,该反应的离子方程式为__________( H2SO5的电离第一步完全,第二步微弱);滤渣的成分为 MnO2、__________(填化学式)。
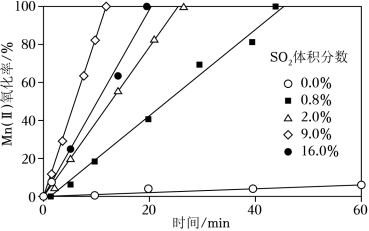
(4)“氧化”中保持空气通入速率不变, Mn(Ⅱ)氧化率与时间的关系如图。 SO2体积分数为__________时, Mn(Ⅱ)氧化速率最大;继续增大 SO2体积分数时, Mn(Ⅱ)氧化速率减小的原因是__________。
(5)“沉钴镍”中得到的 Co(Ⅱ)在空气中可被氧化成 CoO(OH),该反应的化学方程式为__________。
(6)“沉镁”中为使 Mg2+沉淀完全( 25℃),需控制 pH不低于__________(精确至 0.1)。
某废水处理过程中始终保持 H2S饱和,即 c(H2S)=0.1mol•L﹣1,通过调节 pH使 Ni2+和 Cd2+形成硫化物而分离,体系中 pH与 ﹣1gc关系如图所示, c为 HS﹣、S2﹣、Ni2+和 Cd2+的浓度,单位为 mol•L﹣1。已知 Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
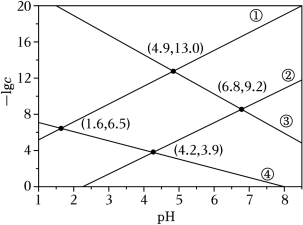
| A. |
Ksp(CdS)=10﹣18.4 |
| B. |
③为 pH与 ﹣lgc(HS﹣)的关系曲线 |
| C. |
Ka1(H2S)=10﹣8.1 |
| D. |
Ka2(H2S)=10﹣14.7 |
晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
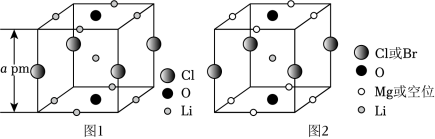
| A. |
图1晶体密度为 72.5NA×a3×10-30g•cm﹣3 |
| B. |
图1中 O原子的配位数为 6 |
| C. |
图2表示的化学式为 LiMg2OClxBr1﹣x |
| D. |
Mg2+取代产生的空位有利于 Li+传导 |
某小组进行实验,向
10mL蒸馏水中加入
0.4gI2,充分振荡,溶液呈浅棕色,再加入
0.2g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知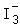 I3-(aq)为棕色,下列关于颜色变化的解释错误的是( )
I3-(aq)为棕色,下列关于颜色变化的解释错误的是( )
|
选项 |
颜色变化 |
解释 |
|
A |
溶液呈浅棕色 |
I2在水中溶解度较小 |
|
B |
溶液颜色加深 |
发生了反应: I2+I﹣⇌I3- |
|
C |
紫黑色晶体消失 |
I2(aq)的消耗使溶解平衡 I2(s)⇌I2(aq)右移 |
|
D |
溶液褪色 |
Zn与有色物质发生了置换反应 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
一定条件下,酸性 KMnO4溶液与 H2C2O4发生反应, Mn(Ⅱ)起催化作用,过程中不同价态含 Mn粒子的浓度随时间变化如图所示。下列说法正确的是( )

| A. |
Mn(Ⅲ)不能氧化 H2C2O4 |
| B. |
随着反应物浓度的减小,反应速率逐渐减小 |
| C. |
该条件下, Mn(Ⅱ)和 Mn(Ⅶ)不能大量共存 |
| D. |
总反应为: 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
某低成本储能电池原理如图所示。下列说法正确的是( )
| A. |
放电时负极质量减小 |
| B. |
储能过程中电能转变为化学能 |
| C. |
放电时右侧 H+通过质子交换膜移向左侧 |
| D. |
充电总反应: Pb+SO42-+2Fe3+═PbSO4+2Fe2+ |
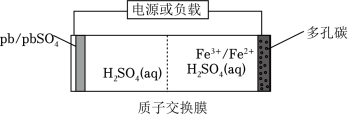
某工厂采用如图工艺制备 Cr(OH)3,已知焙烧后 Cr元素以 +6价形式存在,下列说法错误的是( )
| A. |
“焙烧”中产生 CO2 |
| B. |
滤渣的主要成分为 Fe(OH)2 |
| C. |
滤液①中 Cr元素的主要存在形式为 CrO42- |
| D. |
淀粉水解液中的葡萄糖起还原作用 |
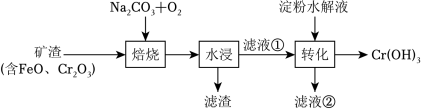
某种镁盐具有良好的电化学性能,其阴离子结构如图所示。 W、X、Y、Z、Q是核电荷数依次增大的短周期元素, W、Y原子序数之和等于 Z, Y原子价电子数是 Q原子价电子数的 2倍。下列说法错误的是( )
| A. |
W与 Y的化合物为极性分子 |
| B. |
第一电离能: Z>X>Y |
| C. |
Q的氧化物是两性氧化物 |
| D. |
该阴离子中含有配位键 |
试题篮
()