某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(l)Ca(OH)2全部转化为CaCO3时消耗的CO2质量为 g;
(2)4.0g样品中杂质CaCO3的质量为多少?(写出计算过程)
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为 (精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果 (填“有”、“没有”)影响.原因是 .

我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是 (选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
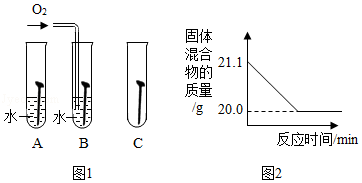
(2)铁钉生锈,属于 变化(选填“物理”“化学”):如图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是 (选填字母)。
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为 。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C 4FeO+CO2↑.现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图2为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成CO2气体的质量为 g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
过碳酸钠(化学式为2Na2CO3▪3H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是 。
A.鱼池供氧剂 B.消毒剂 C.干燥剂 D.漂白剂
(2)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中 有硅酸镁。(填写“可能”或“一定”)
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgNO3溶液
实验操作 |
预期现象和必要结论 |
步骤:1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 |
|
步骤2:取少量步骤1所得的滤液于试管中,加入 ,振荡后静置。 |
。 |
步骤3:取少量步骤2所得的溶液于试管中, 。 |
,说明样品中有MgSO4。 ,说明样品中没有MgSO4. |
过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产生氧气的曲线图。
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 |
相对分子质量 |
纯度 |
价格(元/kg) |
Na2O2 |
78 |
98% |
25 |
CaO2 |
72 |
94% |
24 |
用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?

(1)化学兴趣小组的同学欲除去某FeCl2溶液中混有的CuCl2杂质,实验操作步骤如下:
①在混合溶液中加入过量的 粉(只有一个正确选项,选填字母),搅拌,使其充分反应:
A.铁 B.铜 C.银
②过滤,得到FeCl2溶液和金属混合物.
(2)该小组同学欲继续探究上述②得到的金属混合物中Cu的质量分数,将该金属混合物洗涤、干燥,称得其质量为28.0g.向此金属混合物中逐滴滴加稀盐酸,产生氢气的质量与加入稀盐酸溶液的质量关系如图所示,完成下列问题:
①计算该金属混合物中Cu的质量分数.(请根据化学方程式写出完整的计算步骤)
②该实验中,有同学认为还可以通过测定其他数据来计算Cu的质量分数,实验时他需要测定的实验数据应是 .

皮蛋是我国传统的蛋制品,深受人们喜爱,由少量NaCl、CaO和过量Na2CO3混合得到的粉末状混合物A是腌制皮蛋的配方之一。
(1)某化学兴趣小组从市场获取少量混合物A于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液。
①该过程发生反应的化学方程式为 , 。
②滤液中除含有Cl﹣、OH﹣外,还含有的阴离子是 。
(2)在混合物A中加入少量ZnSO4可改善皮蛋品质,该兴趣小组获得某样品,探究在混合物A中是否添加了少量ZnSO4。
设计实验方案,完成如表表格。
限选用品与试剂:稀盐酸、pH试纸、BaC12溶液、蒸馏水、AgNO3溶液。
实验操作 |
预期现象和必要结论 |
步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤 |
/ |
步骤2:取少量步骤1所得的滤液于试管中, 。 |
|
步骤3: 。 |
,说明样品中有ZnSO4; ,说明样品中没有ZnSO4. |
某化学兴趣小组同学为回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,烧杯内剩余固体27g。
请完成下列分析及计算。
(1)40g铜锌合金中锌的质量是 g。
(2)计算所用稀硫酸中溶质的质量分数。
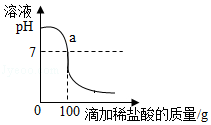
将含有NaCl杂质的某烧碱样品10g完全溶于90g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸.在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示.
(1)求l0g该样品中氢氧化钠的质量.
(2)求a点时,溶液中溶质的质量分数(计箅结果精确到0.1%)
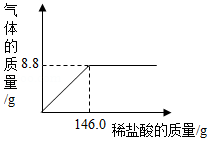
为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量。某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数。
(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)
实验室固体氢氧化钠敞口放置在空气中容易变质而失效,现称取该久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为3.7%的氢氧化钙溶液,产生沉淀与所加氢氧化钙溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填"部分变质"或"全部变质")。
(2)m= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)

改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。某钢铁厂采用赤铁矿(主要成分为Fe 2O 3)炼铁,反应原理为Fe 2O 3+3CO 2Fe+3CO 2.若该厂日产含铁1.4×10 4t的生铁,至少需要含Fe 2O 3 80%的赤铁矿的质量是多少?(要求写出计算过程)
一种新型"人造树叶"可吸收二氧化碳并转化为乙醇(C 2H 5OH)燃料,化学方程式为:2CO 2+3H 2O C 2H 5OH+3O 2.研究显示,一升"人造树叶"每天可从空气中吸收968g CO 2
(1)一升"人造树叶"工作一天可得到乙醇的质量是多少?
(2)若每天一棵树平均可吸收48.4g CO 2,则一升"人造树叶"吸收的CO 2相当于 棵树吸收的CO 2。
"人工固氮"每年能生产11.9亿吨氨(NH 3),反应原理为:N 2+3H 2 2NH 3
(1)根据化学方程式计算:"人工固氮"每年固定氮气的质量是多少?
(2)每年全球"雷电固氮"约能固定0.98亿吨氮气,"人工固氮"固定氮气的质量相当于"雷电固氮"的 倍。
[题干]在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有 产生,反应的化学方程式是 .
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀.
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因.
| 试管(盛有同体积同浓度的盐酸) |
① |
② |
③ |
④ |
| 镁条长度 |
1cm |
2cm |
3cm |
4cm |
| 相同的实验现象(省略题干现象) |
快速反应,试管发热,镁条全部消失 |
|
|
|
| 沉淀量差异(恢复至20℃) |
无 |
少量 |
较多 |
很多 |
| |
|
|
|
|
[得出结论]镁条与盐酸反应产生白色沉淀与 有关.
[追问]白色沉淀是什么物质?
[查阅资料]①20℃时,100g水中最多能溶解氯化镁54.8g.
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸.
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是 (用化学方程式表示).
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
| 试管 |
操作 |
现象 |
结论 |
| A |
加入足量盐酸 |
,白色沉淀 |
猜想一不正确,但这种白色沉淀能溶于盐酸 |
| B |
加入足量水 |
白色沉淀 |
猜想二不正确 |
| C |
加入适量稀硝酸 |
白色沉淀消失 |
原白色沉淀中含有的离子是: Mg 2+、 |
| 继续滴加几滴硝酸银溶液 |
出现大量白色沉淀 |
[拓展延伸]足量镁与盐酸反应过程中,溶液会经历从酸性到碱性并且碱性逐渐增强的过程,从而促使白色碱式氯化镁的生成.
试题篮
()