小苏打常用作焙制糕点的发酵剂,为测定某小苏打样品的纯度,现取样品10g加热到质量不在减少(杂质不参加反应),共收集到二氧化碳2.2g,求样品中小苏打的纯度。提示:碳酸氢钠受热分解的化学方程式:2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
实验室用200g质量分数为3.4%的过氧化氢溶液与少量二氧化锰混合制氧气,完全反应,生成氧气的质量是多少?
如图是某物质甲的溶解度曲线.
求:(1)t1℃,甲的饱和溶液中溶质的质量分数(精确到0.1%);
(2)t2℃,B点对应的溶液是否饱和?
工业盐酸中通常溶有少量的FeCl 3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl 3与NaOH反应的化学方程式为FeCl 3+3NaOH═Fe(OH) 3↓+3NaCl.请回答下列问题:
(1)FeCl 3与NaOH恰好完全反应时,生成沉淀的质量是 g。
(2)该工业盐酸中HCl的质量分数是多少?(写出计算过程)
(3)取l00g该工业盐酸稀释成HCl质量分数为10%的稀盐酸,需加多少克水?(写出计算过程)

为了测定某石灰石样品中碳酸钙的含量,小敏同学取12.5g该样品进行实验,然后将100mL稀盐酸分五次加入该样品中,充分反应后测得每次生成气体的质量如下表所示(样品中的杂质不反应,生成的气体全部逸出)。
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀盐酸的体积/mL |
20 |
20 |
20 |
20 |
20 |
| 生成气体的质量/g |
1.1 |
1.1 |
1.1 |
1.1 |
0 |
请计算:
(1)生成气体的总质量是 g。
(2)碳酸钙(CaCO 3)的化学式量是 。
(3)该石灰石样品中碳酸钙的质量分数(写出计算过程)。
我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
| 加入稀盐酸的总质量(g) |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
| 烧杯中物质的总质量(g) |
47.8 |
70.6 |
93.4 |
116.2 |
141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是 g。
(2)该贝壳样品中碳酸钙的质量分数。
硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
|
反应前 |
反应后 |
||
实验数据 |
烧杯和过氧化氢溶液的质量/g |
硫酸铜溶液的质量/g |
烧杯和烧杯中溶液的质量/g |
|
60 |
3.3 |
62.5 |
||
(1)生成氧气的质量为 g.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).
实验室常用石灰石(主要成分的化学式:CaCO 3)与稀盐酸反应制取二氧化碳.某化学兴趣小组为了探究反应后废液中的成分,将废液过滤,取滤液40g于烧杯中,向其中滴加溶质质量分数为10.6%的碳酸钠溶液直到过量.有关变化如下图所示,根据题中有关信息和图象分析回答下列问题(石灰石中所含杂质不与稀盐酸反应,也不溶于水).
(1)CO 2由 种元素组成.
(2)每个CO 2分子中含有碳、氧原子的个数比为 .
(3)CO 2的相对分子质量是 .
(4)A点处生成沉淀的质量是 g.
(5)计算A点处溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).

重质碳酸钙粉体产业为我市一大支柱产业,产品远销全国各地.某化学兴趣小组对粉体中碳酸钙含量进行了探究,小组成员从一包粉体产品中取出样品5.10g放入烧杯中,并逐滴加入相同浓度的稀盐酸(假设样品中的杂质不参与盐酸反应),实验测得烧杯中物质总质量与加入稀盐酸的总质量关系如表所示.
| 稀盐酸的总质量(g) |
10.00 |
20.00 |
30.00 |
40.00 |
50.00 |
60.00 |
70.00 |
| 烧杯中物质总质量(g) |
14.66 |
24.22 |
m |
43.34 |
52.90 |
62.90 |
72.90 |
(1)碳酸钙的相对分子质量为 .
(2)表中m= .
(3)求样品中碳酸钙的质量分数(结果保留两位小数).
根据如图所示的实验过程和所提供的数据计算(假设恰好完全反应)。

(反应的化学方程式为:K2CO3+CaCl2 ═CaCO3↓+2KCl)
(1)CaCl2中钙元素和氯元素的质量比为 。
(2)样品中碳酸钾的质量分数(写出计算过程)。
(3)反应后所得溶液中氯化钾的质量(写出计算过程)。
葡萄糖(C6H12O6)溶液与银氨溶液[主要成分是Ag(NH3)2OH]反应,可以在玻璃表面均匀地镀上一层银,工业上可用于制镜,该反应为:C6H12O6(葡萄糖)+2Ag(NH3)2OH C6H15O7N(葡萄糖酸铵)+2Ag↓+3NH3↑+H2O.请回答以下问题.
C6H15O7N(葡萄糖酸铵)+2Ag↓+3NH3↑+H2O.请回答以下问题.
(1)葡萄糖分子中碳、氢、氧三种原子个数比为 ,碳元素的质量分数为 .
(2)若制镜需要用银21.6g,列式计算需要葡萄糖的质量.
小黄同学为了测定某Cu﹣Ag合金中各金属的含量,取这种合金4.8 g与AgNO3溶液反应,加入AgNO3溶液的质量m与充分反应后所得固体的质量b的关系如图所示.请计算:
(1)AgNO3溶液中溶质的质量分数(结果精确 至0.1%);
(2)该合金中银和铜的质量比(结果精确至0.1).

用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
(1)现有南方产的一种煤含硫8%.某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是多少?
(2)如在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在如图坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。
[已知]①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;
②CaSO3和盐酸反应类似于CaCO3。
(3)向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3.现用一万元分别购买两种原料来除去SO2,相关数据如表:
方法 |
物质 |
相对分子质量 |
纯度 |
价格(元/t) |
除SO2的量(t) |
A |
石灰石 |
100 |
90% |
200 |
14.4 |
B |
熟石灰 |
74 |
94% |
500 |
14.6 |
方法B比方法A除SO2的量略大,而且工业上多数采用方法B.其原因分别是: 。
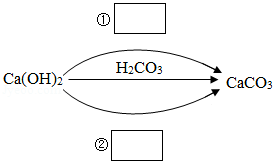
(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。
(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
| 反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
试题篮
()