(1)某学习小组为测定M硫酸厂排放的废水中的硫酸含量进行如下实验:取50g废水于烧杯中,滴入质量分数为10%的氢氧化钠溶液(假定废水中其他成分不与氢氧化钠反应),当废水pH 时(填">7"、"=7"、"<7")反应恰好完全,测得消耗该氢氧化钠溶液8g,据此计算该废水中硫酸的质量分数.
(2)M硫酸厂常用熟石灰对废水进行处理并产生硫酸钙,已知M厂每天用这种方法处理废水50吨,计算M厂每天理论上能产生多少吨硫酸钙.
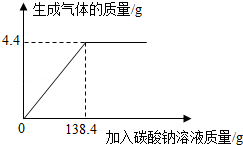
向一定质量、一定溶质质量分数的稀盐酸中逐滴加入某碳酸钠溶液.实验过程中,产生气体质量与加入碳酸钠溶液的质量关系如图所示,试计算:
(1)恰好完全反应时,生成气体的质量为 g;
(2)恰好完全反应时,所加碳酸钠溶液中Na2CO3的质量是多少?
(3)若恰好完全反应时所得溶液的溶质质量分数为5%,则稀盐酸的溶质质量分数是多少?
铜是一种常见的金属,在生活、生产中有广泛的应用.
(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的 性;
(2)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了"铜绿"[化学式:Cu x(OH) yCO 3].
小明和小丽为了探究"铜绿"的组成,查阅资料:"铜绿"受热易分解生成CuO、CO 2和H 2O.他们进行如下实验:称取22.2克"铜绿",充分加热至固体质量不再改变,把产生的气体全部依次通过足量浓硫酸和足量氢氧化钠的溶液,发现浓硫酸增重1.8克,氢氧化钠溶液增重4.4克.
根据以上实验.他们推断出:x= ,y= ;铜与潮湿空气中变成"铜绿"的化学方程式是 ;
(3)小明和小丽分别取24.0克氧化铜,用CO还原制铜,小明得到19.2克红色固体,小丽得到20.8克红色固体.他们质疑:为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu 2O)
Ⅱ.Cu 2O+H 2SO 4(稀)═Cu+CuSO 4+H 2O
他们分析推断:
①一致认为 (填"小明"或"小丽")的产物中没有Cu 2O;
②用CO还原a克Cuo得到红色固体b克,若红色固体为Cu和Cu 2O的混合物,则a与b的数量关系是 ;
③还可以简单的实验验证红色固体是否有Cu 2O,请简述操作、现象及结论: .
工业上煅烧石灰石(CaCO 3)可制得生石灰(CaO)和二氧化碳,如果要制取2.8t氧化钙,计算需要碳酸钙的质量.
通过化学变化可以制备物质。
(1)某兴趣小组欲用200g 4%的氢氧化钠溶液吸收二氧化碳制备碳酸钠,反应的化学方程式是 ;若要将提供的氢氧化钠全部转化为碳酸钠,请列出计算需二氧化碳质量(x)的比例式 ;
(2)在实验中,该小组同学发现,要定量控制通入氢氧化钠溶液中二氧化碳气体的质量,难以操作。请分析若通入二氧化碳气体的量不足时会导致产物中混有的杂质是 ;
(3)查阅资料:
Na2CO3+CO2+H2O=2NaHCO3;
NaHCO3+NaOH=Na2CO3+H2O;
该小组同学将制备方案改进如下:
步骤 |
实验操作 |
实验目的 |
一 |
将200g 4%的NaOH溶液分为两等份 |
/ |
二 |
① |
将其中一份溶液中的NaOH全部转化为NaHCO3 |
三 |
将步骤二所得溶液小心煮沸1﹣2分钟 |
② |
四 |
③ |
将NaHCO3全部转化为Na2CO3 |
(4)假设每步转化都完全,该小组同学利用改进后的方案制取的碳酸钠质量m1= g;经老师指导,该小组同学将步骤四反应后的溶液蒸干并充分灼烧得到碳酸钠粉末的质量为m2g,发现m1=m2,由此证明他们的方案改进成功。
FeCl2溶液中混有 少量的CuCl2,为了除去CuCl2,某课外小组同学取该溶液50g于烧杯中,然后等量分5次加入某物质M充分反应,所得数据如下表,请根据相关知识和数据回答下列问题:
次数 |
1 |
2 |
3 |
4 |
5 |
加入M的质量(g) |
0.28g |
0.28g |
0.28g |
0.28g |
0.28g |
溶液的总质量(g) |
49.96g |
49.92g |
49.88 g |
49.84 g |
49.84 g |
(1)写出物质M的化学式 。
(2)参加反应M的总质量是多少?
(3)FeCl2溶液中CuC12的质量分数是多少?
化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如图所示(假设铁片除有Fe2O3外,不含其他杂质)。
(1)生成氢气的质量为 g;
(2)所用稀盐酸中溶质的质量分数为 。
(3)计算该铁片中Fe2O3的质量分数(写出计算过程)。

我国南海蕴藏着丰富的油气资源。工业上可用甲烷(CH4)裂解制取高质量炭黑和氢气,反应的化学方程式为:CH4 C+2H2,现将32吨甲烷裂解,可制得氢气的质量是多少?
小红将30g氯酸钾和二氧化锰的固体混合物加热制取氧气,待反应完全后,将试管冷却、称量,得到固体的总质量为20.4g,请计算:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾的质量是多少?
(3)混合物中二氧化锰的质量是多少?(写出计算过程)
Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 |
① |
② |
③ |
④ |
NaOH溶液质量/g |
10.0 |
20.0 |
30.0 |
40.0 |
Mg(OH)2质量/g |
0.232 |
0.522 |
0.580 |
0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算100g混合溶液中含MgSO4的质量(写出计算过程)。
(3)分析实验数据,在图中,画出加入4% NaOH溶液质量0﹣30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。

已知:①NaHCO3 固体受热分解 2NaHCO3 Na2CO3+CO2↑+H2O;②Na2CO3 受热不分解。回答下列问题:
(1)关于 NaHCO3 固体的叙述错误的是 (填标号)。
A.俗称小苏打 B.难溶于水
C.可与稀盐酸发生反应 D.是发酵粉的主要成分之一
(2)欲测定某 NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将 5.0g 该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH 7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为 。
②由图中数据可知,上述5.0g NaHCO3 样品完全分解产生CO2的质量为 g,产生H2O的质量是 g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)。

已知金属钴(Co)的活动性与铁相似,请预测氯化钴(CoCl2)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,钴的化合物相关性质如下:
物质 |
CoO |
Co(OH)2 |
CoCl2 |
CoSO4 |
Co(NO3)2 |
CoCO3 |
在水中的溶解性 |
难溶于水的灰绿色固体 |
难溶于水的粉红色固体 |
易溶于水形成粉红色溶液 |
易溶于水形成粉红色溶液 |
易溶于水形成粉红色溶液 |
难溶于水的粉红色固体 |
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
预测 |
预测的依据 |
验证预测的实验操作与预期现象 |
①能够与含Ag+的 可溶性盐反应 |
CoCl2 溶液中含Cl﹣, AgCl难溶于水。 |
取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立。 |
②能够与 (填物质类别)反应 |
|
取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立。 |
③能够与 (填物质类别)反应 |
|
取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立。 |
某兴趣小组用氯酸钾与二氧化锰的混合物制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液200g。
| 加热时间/min |
0 |
t 1 |
t 2 |
t 3 |
| 固体质量/g |
26.0 |
23.4 |
16.4 |
16.4 |
请计算:
(1)共制得氧气 g。
(2)所得氯化钾溶液中溶质的质量分数。
某化学兴趣小组的同学取氢氧化钠和碳酸钠的混合溶液50g装入烧杯中,每次滴加50g稀盐酸充分反应。测得部分数据及图象如下:
次数 |
1 |
2 |
3 |
4 |
5 |
加入稀盐酸的质量/g |
50 |
50 |
50 |
50 |
50 |
烧杯中物质的质量/g |
100 |
150 |
197.8 |
245.6 |
295.6 |
请根据有关信息计算:
(1)a的数值为 。
(2)求稀盐酸中溶质的质量分数。(写出计算过程)
(3)求恰好完全反应后所得溶液中溶质的质量。(写出计算过程)

试题篮
()