某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
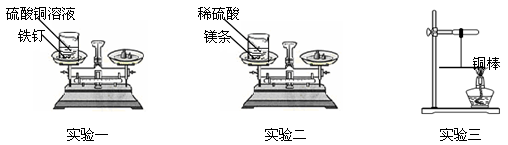
【设计并实验】
实验一:将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验二:将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验一和实验二的数据见下表:
| 编 号 |
实验一 |
实验二 |
| 反应前/g |
118.4 |
112.6 |
| 反应后/g |
118.4 |
112.4 |
实验三:用细线系住铜棒中点使之平衡,然后在铜棒一端用酒精灯加热。加热一段时间后,观察到铜棒的平衡情况是 。
【分析与讨论】
(1)在这三个实验中,你认为:实验 正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是 。
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是 (只写其中一个实验的原因即可)。
【实验反思】小组成员从不能正确反映反应物和生成物之间质量关系的两个实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在 中进行。
某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4 g钢样品和30.0 g稀盐酸(足量)放入质量为130.0 g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
| 反应时间 |
T0 |
T1 |
T2 |
T3 |
| 烧杯和药品质量/ g |
171.4 |
171.3 |
171.0 |
171.0 |
(1)计算这种钢样品中铁的质量分数。(最后结果精确到0.1%)
(2)某钢厂欲冶炼1120 t这种钢材,需含氧化铁80%的赤铁矿多少吨?
研究小组进行木炭还原氧化铁的探究活动。将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨。取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失)。

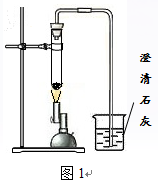
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下:
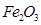 为红色固体;
为红色固体;  和
和 均为黑色固体。其中,
均为黑色固体。其中, 具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl ══ 2FeCl3+3H₂O
Fe3O4+8HCl ══ 2FeCl3+FeCl2+4H2O
FeO+2HCl ══ FeCl2 + H2O
黄色的 溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验
溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验 ;
; 溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
【猜想】固体X可能含有:① ②
② ③
③ ④ ⑤
④ ⑤
【实施实验】
目的:确定固体X的组成。
| 步骤 |
操作 |
主要现象 |
结论 |
| I |
取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引。 |
部分固体被吸引到磁铁上 |
可能有 或 或 |
| II |
取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热。 |
固体剧烈燃烧, b中溶液变浑浊 |
一定有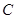 |
| III |
另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸。 |
无明显现象 |
一定没有 |
| IV |
取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸。 |
产生 。 |
一定有 |
| V |
在步骤IV所得溶液中逐滴加入 。 |
溶液不变红色 |
一定没有 |
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有 ,理由是 。
,理由是 。
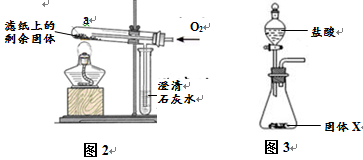
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 |
操作 |
数据 |
| I |
重新取部分冷却至室温的固体X,称量其质量为m1。 |
m1 =" 17.9" g |
| II |
将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3。 |
m2 =" 317.9" g m3 = 317.3.g |
| III |
将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4。 |
m4 =" 1.1" g |
【获得结论】
(1)为确定固体X中是否含 ,m1~m4中应该用到的数据有 。
,m1~m4中应该用到的数据有 。
(2)固体X的成分及质量分别是 。
下列图像能正确反映对应变化关系的是( )
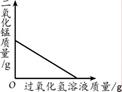 |
 |
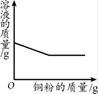 |
 |
| A.向一定量的MnO2中加入H2O2溶液 |
B.加热一定量的高锰酸钾固体 |
C.向一定量的硝酸银溶液中加入铜粉 |
D.向两份完全相同的盐酸中加入镁和锌 |
某化学兴趣小组按照课本实验方法(如下图),做木炭与氧化铜反应的实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现。他们决定对这个实验进行探究和改进。
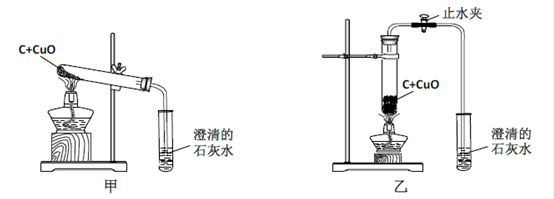
【提出问题】暗红色的固体是什么?如何选择合适条件,使木炭还原氧化铜的实验现象更明显?
【查阅资料】铜有+1 和+2 两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4 或-4。
【猜想与假设】
(1)同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为 。
(2)同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象
更加明显,减少出现暗红色固体的情况。
【分析与交流】
(1)小吴建议用超细炭粉与氧化铜粉末进行实验。你认为这样建议的原理是 ;反应的化学方程式为 。
(2)小周建议用图乙装置替代甲装置。与甲相比较,乙装置中将试管直立放置的好处是 。
【实验与结论】
同学们决定按改进后的方案进行实验,他们在检验了乙 后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时, (填“可以”或“不能”)确定氧化铜和炭粉已经开始反应。不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是 (填“吸”或“放”)热反应。待产物冷却后,同学们终于找到了期待已久的紫红色铜珠,实验获得了圆满成功。
已知A、B、C、D、E为初中化学中常见的五种不同类别的物质,其中A为年产量最高的金属单质,各种物质间的反应和转化关系如图所示(“——”表示相连的两种物质之间可以发生反应,“―→”表示一种物质可以转化为另一种物质;反应条件、部分反应物和生成物已略去)。请写出:
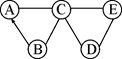
(1)B的化学式:_____________________;
(2)D与E反应的化学方程式:_ __。
A、B、C、D是初中化学常见的物质,其中A为无色气体单质,B、C为氧化物,且B为有毒气体,D是大理石的主要成分,它们之间的转化关系如下图所示(图中反应条件及部分反应物、生成物已省略)。
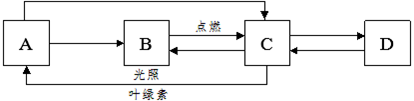
回答下列问题:
(1)写出下列物质的化学式:A ;B ;C 。
(2)实验室常用 鉴别B和C。
(3)写出由物质C转化为物质B的化学方程式 。
(4)写出物质C与过氧化钠(Na2O2)反应生成碳酸钠和物质A的化学方程式 。
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
(1)样品中铜的质量分数;(3分)
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液中溶质的质量分数。(精确到百分之零点一)
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓

(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为 g.
(2)计算MgSO4溶液中溶质的质量分数(列式计算).
某实验小组为探究酸的化学性质,由甲、乙同学设计并完成了如图所示的实验.
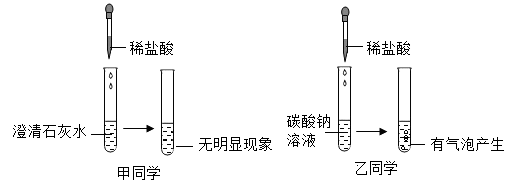
(1)甲同学实验中所发生的化学方程式为 .
【查阅资料】CaCl2、NaCl的溶液呈中性,Na2CO3溶液呈 (填“酸”或“碱”)性.
【实验探究一】确定甲、乙同学上述实验后所得溶液中的溶质.
(2)取甲所得溶液少许,加入石蕊试液,溶液显红色,甲所得溶液中一定含有的溶质是 (写化学式)
(3)取乙所得溶液少许,加入酚酞试液,溶液显红色,乙所得溶液中一定含有的溶质是 (写化学式)
【实验探究二】
(4)甲、乙同学把上述实验所得溶液倒入同一废液缸中,观察到废液缸中产生少量气泡,最终有白色沉淀生成,该白色沉淀是 (写化学式).
【讨论交流】丙同学提出:若将上述废缸中物质取出,过滤,所得滤液中含有哪些物质呢?经过讨论大家一致认为:一定含有NaCl,可能含有CaCl2、盐酸和Na2CO3中的部分物质.
【实验探究三】取少量滤液于试管中,滴加过量的稀硝酸,可观察到有大量气泡产生.
【归纳总结】该滤液中含有的溶质是氯化钠和 (写化学式).
【探索与拓展】有一份由Na2SO4、NaCl两种物质组成的固体样品.为确定其组成,上述小组同学将样品全部溶于蒸馏水中制成119.3g溶液,再往其中加入104gBaCl2溶液,两者恰好完全反应.过滤,得到23.3g白色沉淀和一定质量的滤液.经测定,该滤液中溶质质量分数为9%.试计算:(均需计算过程)
(5)所用B2Cl2的溶液中溶质的质量分数.
(6)所用样品的质量.
在学习酸、碱、盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液
(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究。
探究一:
溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是,②是
。
【收集资料】
水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量
溶液于试管中,向其中滴入 |
溶液变红 |
猜想①正确 |
探究二:过滤后澄清滤液中会有哪些溶质?
【提出猜想】
猜想一:
和
;
猜想二:;
猜想三:
.
(3)【实验验证】同学们针对"猜想一"进行如下实验:
| 实验操作 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
"猜想一"不成立 |
他们的实验结论是否正确?(填"是"或"否")
(4)【继续探究】设计如下实验方案确定滤液中溶质的组成.
| 实验操作 |
实验现象 |
实验结论 |
| 分别取少量滤液于
两支试管中,
中加入
溶液,
中加入溶液 |
若
中产生白色沉淀,
中没有沉淀 |
"猜想一"成立 |
| "猜想二"成立 |
||
| 若
中都没有沉淀产生 |
"猜想三"成立 |
(5)【反思与拓展】
①为防止标签被腐蚀而破损,倾倒液体时。
②在分析反应后所得溶液中溶质时,除考虑可溶性的生成物,还应考虑。
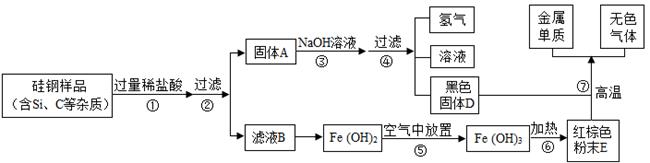
硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有
、
、
),设计了如图的试验流程(有些反应的部分反应物和生成物已省略).查阅资料发现常温下,单质硅(
)不能与盐酸反应,但能与氢氧化钠溶液反应(
).
根据以上信息,回答下列问题:
(1)固体A的成分为,滤液B中的金属阳离子为;
(2)写出步骤⑦中发生反应的化学方程式;其基本反应类型为;
(3)在过滤操作时,若发现滤液浑浊,应;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式.
小红、小军、小明三人化学学习小组在实验中,用到了三个分别盛有KCl溶液、KOH溶液、K2SO4溶液的滴瓶.
小军发现小红将三个滴瓶中的三只滴管混用,认为小红实验操作不规范,滴瓶中的试剂会因此受污染而无法再次使用,学习小组就盛有KCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究.
【提出问题】该滴瓶中溶质的成分是什么?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ溶质成分只有:
;
猜想Ⅱ溶质成分为:
和
;
猜想Ⅲ溶质成分为:;
猜想Ⅳ溶质成分为:
、
和
。
【实验探究】为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告;
| 实验操作 |
实验现象 |
结论或解释 |
| (1)取该滴瓶内溶液烧了于试管中,向试管中加入适量
溶液 |
产生白色沉淀 |
该反应的化学方程式为 |
| (2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入 酚酞试液 |
证明猜想Ⅳ成立 |
【实验反思】小明认为该实验方案并未证明猜想Ⅱ、Ⅲ是否成立,应补充相应实验予以证明,你是否赞
同?(选填"是"或"否").
工业制取碳酸钠常会含有少量的氯化钠.实验探究小组欲测定碳酸钠样品中碳酸钠的质量分数,取该样品11
加入64.4
水形成不饱和溶液,然后向其中加入一定量的稀盐酸,恰好完全反应,所得溶液的溶质质量分数10%。产生二氧化碳的质量与时间的关系如图所示:
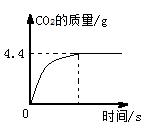
(1)求该样品中碳酸钠的质量分数.(结果精确到0.1%)
(2)求恰好完全反应时所加稀盐酸的质量.
如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种.图中相连的两圆表示相应物质能发生反应,已知乙是铁.下列说法错误的是()
| A. | 五种物质中,只有铁是单质 | B. | 丙是盐酸 |
| C. | 戊是氢氧化钙 | D. | 甲与丁反应属于复分解反应 |
试题篮
()