甲、乙、丙、X是初中化学常见的四中物质.它们的转化关系如图所示(部分产物略去,图中“”表示甲和丙都能与X反应生成乙).
(1)若甲为二氧化碳,乙为一氧化碳,丙为氧气.
①X的化学式为 .
②甲、乙、丙三种气体中有毒的是 .
(2)若甲为碳酸氢钠,乙为氯化钠,丙为碱.
①丙的名称为 .
②物质X (“能”或“不能”)清除铁制品表面的锈.
(3)若X为石灰水,甲为碳酸钠,丙为气体.
①X与甲的溶液反应,其反应的类型是 .
②丙与足量X反应的化学方程式为 .
某同学用多中方法来鉴别物质,其中完全正确的是:
| 需鉴别的物质 |
所加试剂及方法 |
||
| 方法1 |
方法2 |
||
| A |
木炭粉和氧化铜 |
加水观察是否溶解 |
通CO并加热 |
| B |
氢氧化钠溶液和碳酸钠溶液 |
稀盐酸 |
无色酚酞试液 |
| C |
CO和CO2 |
闻气味 |
澄清石灰水 |
| D |
稀盐酸和氯化钠溶液 |
Fe |
pH试纸 |
(5分) 55.7 g碳酸钠溶液恰好与36.5 g某盐酸溶液完全反应,测得反应后溶液的质量为90 g,求:
(1)生成了多少克二氧化碳?
(2)反应后所得溶液的溶质质量分数是多少?
(3)所用稀盐酸中溶质的质量分数。
(5分) A、B可发生中和反应,D是生活中最常见的液体。通常情况下,F、G、I为气体,且F是一种清洁能源。X是目前应用最广泛的金属,Y常用作食品干燥剂。各物质问的转化关系如图所示(个别 产物略去)。
(1)B俗称 。
(2)F与G混合后遇明火可能发生 ,与F此性质相似的气体还有 。(写一种物质化学式)
(3)反应 ③的反应类型是 ;
(4)反应②的化学方程式为
同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3; 你认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 。
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
| 实验步骤 |
实验现象 |
实验结论 |
| 取滤液于试管中 |
|
猜想正确 |
甲同学也针对自己的猜想进行了如下实验。
| 实验步骤 |
实验现象 |
实验结论 |
| 取滤液于试管中滴加少量的稀盐酸 |
无明显现象 |
猜想正确 |
你认为甲同学的实验结论是否正确 (填正确或不正确),理由是 。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑
。
A、B、C、D为初中常见的物质.A与B之间发生的化学反应可表示为:“A+B→C+D”.
(1)若C为氯化钠,D为氧化物,且在A溶液中加入铁粉能产生氢气,则A为 .若A、B两溶液恰好完全反应,则反应后溶液的PH 7(填“>”或“<”或“=”).
(2)若A和B均为黑色粉末,A与B反应时可观察到黑色粉末变为红色,同时生成能使澄清石灰水变浑浊的无色气体,则A与B反应的化学方程式为 .
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。现做如下实验:(1)取少量粉末,加水溶解得无色溶液;(2)另取少量粉末,滴加稀盐酸,无明显现象。请回答:
①由实验(1)可确定原粉末中一定没有 ; 由实验(2)可确定原粉末中一定没有 。②为进一步确定原粉末的组成,另取少量粉末按如图所示进行实验:(每步所加试剂均不同) 
原粉末的成分是 ,写出无色溶液与X反应生成白色沉淀的化学方程式 。
现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100 g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生氢气的质量为m。下列说法正确的是( )
| A.若混合物为Fe、Al,m可能是0.2 g |
| B.若混合物为Fe、Zn,m可能是0.2 g |
| C.若混合物为Fe、Zn,m可能是0.1 g,则该混合物中铁的质量分数为50% |
| D.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3% |
下列与化学有关的知识,完全正确的一组是
| A.常见物质的鉴别 |
B. 环境保护 |
| 羊毛和化纤——点燃后闻气味 磷矿粉和氯化铵——观察颜色 硬水和软水——加肥皂水搅拌 |
白色污染——只对人的视觉感观有影响 温室效应——对大气环境有影响 重金属污染——对人体内蛋白质有影响 |
| C. 化学与生活 |
D. 化学中常见的“三” |
| 汽油去油污与洗涤剂去油污——原理相同 蛋白质与油脂——组成元素相同 合金与纯金——硬度相同 |
H2、C、 CO2 ——三种具有还原性的物质 分子、原子、离子——三种构成物质的粒子 棉花、羊毛、天然橡胶——三大天然有机高分子材料 |
化学是研究物质的组成、结构、性质及变化规律的科学。
(1)①铜、②干冰、③氯化钠三种物质中,由离子构成的是 (填写序号,下同),可用于人工降雨的是 。
(2)食醋中含有醋酸(CH3COOH),醋酸由 种元素组成,其分子中氢、氧原子个数比为 。
(3)气体A和气体B接触可发生反应,生成固体C和液体D,其微观过程如下所示。

图1 图2
① 该反应过程中,属于氧化物的是 (填名称)。
② 将等体积的两只集气瓶中分别盛满A、B,如图2所示进行实验。已知相同条件下,气体的体积比等于分子个数比, 则充分反应后,剩余的气体是 (填化学式)。
(4)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
① 用pH试纸检测废水呈碱性的方法是 。
② 若某造纸厂废水中含NaOH的质量分数为l.6%,现有废硫酸9.8t(H2SO4的质量分数为20%),可以处理的废水质量是多少?(写出计算过程)
以下是我们日常生活中常用各种清洗剂。
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
活氧彩漂 |
污渍爆炸盐 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过氧化氢 |
过碳酸钠 |
(1)我们使用洗涤灵清洗餐具上的油污,这是因为它具有 的功能。
(2)清除以下物质,可以使用洁厕灵的是 填字母序号)。
A.铁锈 B.水垢(主要成分为碳酸钙和氢氧化镁)
C.油渍 D.氢气还原氧化铜实验后,试管内壁残留的红色固体
(3)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,这一反应了体现右图中 (选填①②③④)性质关系。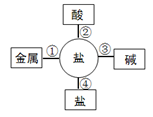
(4)将洁厕灵滴入炉具清洁剂中,如图甲所示。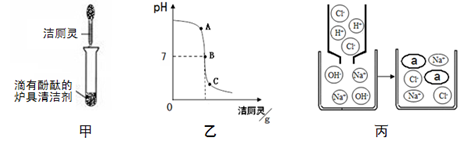
①若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外) ;此时溶液可用图乙中 点处(选填A、B、C)表示。
②若反应后溶液pH为7,图丙中a微粒的化学式为 。
(5)①“活氧彩漂”可用于漂洗衣物、杀菌消毒等,原因是其有效成分过氧化氢分子中含有“过氧基”(—O—O—)。据此推测,下列物质中,可用作杀菌消毒剂的是 (填序号)。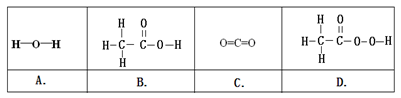
②氧化氢溶液常用于医用消毒,某兴趣小组为测定一瓶久置的医用过氧化氢溶液中溶质质量分数。他们取该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示。试计算该过氧化氢溶液中溶质的质量分数。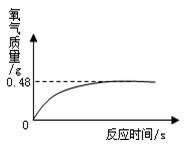
(写出计算过程)
下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答:
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
下列实验方案合理的是( )。
| 选项 |
实验目的 |
所用试剂或方法 |
| A |
除去二氧化碳中少量的一氧化碳 |
通入氧气、点燃 |
| B |
除去氯化钠中少量的氯化银 |
溶于水、过滤、蒸发结晶 |
| C |
验证锌、铜、金的金属活动性 |
加盐酸 |
| D |
除去生氢氧化钠中少量的碳酸钠 |
加足量的稀盐酸至不再产生气泡 |
(9分)我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下: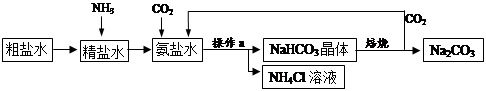
【资料】四种盐在不同温度下的溶解度表
| |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
| NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NH4HCO3 |
15.8 |
21.0 |
27.0 |
—— |
—— |
| NaHCO3 |
8.1 |
9.6 |
11.1 |
12.7 |
—— |
| NH4Cl |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
⑴检验粗盐水是否为硬水的方法是加入 ;
⑵操作a是 ,生产流程中被循环利用的物质是 ;
⑶在精盐水中先通入NH3,使溶液呈 性,再通入CO2,有利于对CO2的吸收;
⑷氨盐水中通入二氧化碳后,在常温条件下,易析出NaHCO3晶体而不析出NH4Cl晶体的可能原因是 ;
⑸粗盐水中主要含有CaCl2、MgCl2等杂质,工业上常加入下列物质除杂、精制,则加入下列三种试剂合理的顺序为 (填序号);
A.适量的盐酸 B.稍过量的Na2CO3溶液 C.稍过量的Ca(OH)2溶液
⑹副产品NH4Cl可做 肥,若加入氢氧化钠加热,反应的化学方程式为 。
.为测定某地石灰石中碳酸钙的质量分数,兴趣小组同学取一定质量的石灰石于烧杯中,向烧杯中逐渐加入较浓的盐酸,反应过程测得剩余固体质量与加入盐酸的质量关系如图所示(石灰石中的杂质不与盐酸反应,也不溶与水)。请回答下列问题:
(1)石灰石中所含杂质的质量是 g。
(2)通过计算求所用盐酸的溶质质量分数。
(3)兴趣小组同学用测定产生的气体质量来求出石灰石中碳酸钙的质量分数,假如测量准确,通过计算得到的碳酸钙的质量分数比实际数值偏大,其原因可能是: 。
试题篮
()