经科学检测,蛋壳中含碳酸钙83—85%,蛋白质15—17%,并含有多种微量元素锌、铜、铁、硒等。小波同学为了亲自检测蛋壳中的某些成分以及含量,进行了实验探究。请回答相关问题:
(1)关于蛋壳的叙述中,你认为错误的一项是( )
| A.含钙、锌、铜、铁、硒等微量元素 |
| B.是由无机物和有机物等组成的混合物 |
| C.蛋壳焙干研粉,胃病患者服用,有止痛和治疗胃酸过多的效果 |
| D.可以加工成乳酸钙、葡萄糖酸钙等产品,变废为宝 |
(2)为验证蛋壳的主要成分是碳酸钙,小波从“稀盐酸”、“氢氧化钙溶液”、“碳酸钠溶液”三类物质中选择出了合理的药品,请你帮他设计简单的实验方案:
。
(3)如果实验过程和测定的相关实验数据如下所示:
请根据以上数据计算蛋壳中碳酸钙的质量分数。(写出计算过程,结果精确到0.1%)
已知某固体混合物中可能含有NH4Cl、Na2SO4、NH4NO3、CuO四种物质中的两种或多种。按下图所示进行实验,出现的现象如图所述(假设过程中所有发生的反应都恰好完全反应)。
根据实验过程和发生的现象填写以下空白:
(1)气体A溶液的pH_______7。(填“<”、“>”或“=”中合适的项)
(2)沉淀D的化学式为 。
(3)在溶液E中,一定大量存在的酸根离子是(写离子符号) 。
(4)实验过程④中发生反应的化学方程式为 。
(5)该固体混合物中,还不能确定存在的是 ,要进一步推理该固体混合物的组成,可用溶液E再实验,请简要说明实验操作步骤、发生的现象及结论:
CO2和CO的混合气体3.6g与足量灼热的氧化铁充分反应后,将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,则原混合气体中CO质量为( )
| A.4.4g | B.2.8g | C. 1.4g | D.0.8g |
(某纯碱样品中混有少量的氯化钠,为了测定该样品中碳酸钠的质量分数,小明同学准确称取 12.0g样品,做了如下实验:
请回答下列问题:
(1)操作X用到的玻璃仪器除烧杯、玻璃棒外,还必需有 。
(2)滤液 C中的溶质是 ,若向滤液 C中滴加稀盐酸,写出过程中发生的一个中和反应的化学方程式 。
(3)若将滤渣B洗涤烘干后,称量其质量为 10.0g , 计算纯碱样品中的 Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
现有某不纯的碳酸钠固体样品,已知其中含有的杂质可能是Na2SO4、CuSO4、NaCl、CaCl2中的一种或几种。为确定其杂质的成分,进行如下实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全进行)。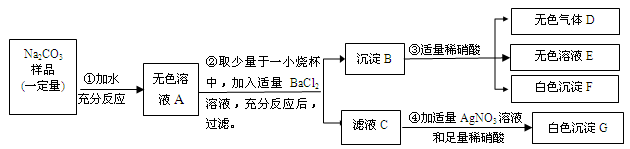
请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)气体D能使紫色石蕊试液 。
(2)无色溶液E中的酸根离子的符号是 。
(3)该碳酸钠固体样品中一定含有的杂质是 ,一定不含有的杂质是 。
(4)请写出过程④中发生反应的一个化学方程式 。
(5)碳酸钠固体样品中还不能确定的物质是 。要确定它是否存在,可另取溶液A再实验。请简述你的设计方案(说明实验操作步骤、发生的现象及结论)。
。
向溶质的质量分数为17%的硝酸银溶液中逐滴滴入稀盐酸,测得滴入盐酸的质量与生成沉淀的质量有如图所示关系,则恰好完全反应时所得溶液中溶质的质量分数为
| A.6.3% | B.7.3% | C.10% | D.17% |
某兴趣小组同学为了验证铁和铜的金属活动性强弱,进行了如下的实验研究,请你回答有关问题:
[实验探究]
(1)甲同学设计的实验方案:取用砂纸打磨过的铁丝插入到盛有硫酸铜溶液的试管中,过一会儿取出铁丝,观察到铁丝表面_____________,得出结论铁比铜活动性强。
(2)乙同学设计的方案:(实验中所用铜片,铁片大小形状相同,且表面洁净光亮)
| 实验步骤 |
实验现象 |
实验结论 |
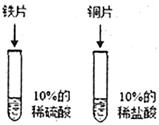 |
铜片的表面无气泡产生 铁片的表面有气泡产生 |
铁比铜的活动性强 |
[讨论交流]
(1)铁片与稀硫酸反应一段时间后溶液中可能含有的溶质是______________。
(2)实验前乙同学在配置10%的稀盐酸时,用到的仪器有烧杯、量筒、胶头滴管,还缺少的一种仪器是______________。在量取蒸馏水的体积时,若仰视读数,则会导致盐酸的溶质质量分数_________10%(填“>”“<”、“=”)
[反思评价]
你认为乙同学的方案__________(填“合理”或“不合理”),理由是:______________
[拓展应用]
农药波尔多液的主要成分是硫酸铜,不能用铁制容器盛放波尔多液的原因是:
____________________________________(用化学方程式表示)
A~F均为初中所学的物质。其中属于碱的是B、C,属于盐的是D、E,其中D是钠盐;胃酸中含有F能帮助消化,A是食品包装袋中常用的干燥剂。其物质间的转化关系如图所示。图中“—”表示两端的物质能发生反应;“→”表示物质间存在转化关系,其余反应条件、部分反应物和生成物均已略去。试回答:
(1)A的俗名是__________________;
(2)写出C物质的化学式__________________________;
(3)写出反应①的化学方程式:_______________________________________;
(4)图中的相互关系中没有涉及的基本反应类型是:__________________________。
实验室有一瓶存放时间过长的氢氧化钠固体,其中一部分已转化成了碳酸钠。现需用该药品配制氢氧化钠溶液。取6克该药品,溶于13.7mL水中(水的密度为1g/cm3),然后慢慢地滴加溶质质量分数为7.4%的澄清石灰水,当用去10克澄清石灰水时,碳酸钠恰好反应完全。计算:(1)6克该药品中碳酸钠的质量;(2)滤出沉淀后所得溶液的溶质质量分数。
有一包固体样品,可能是碳酸钠、硫酸铜、氢氧化钠、氯化钡中的一种或几种。为探究其成分,李老师取用一定量样品,加水溶解,过滤得到白色沉淀甲和无色滤液乙。
【探究活动一】自主小组探究白色沉淀甲的成分。
| 实验操作 |
实验现象 |
结论 |
| 取白色沉淀甲,滴加足量的稀盐酸 |
沉淀消失 |
白色沉淀甲中一定含有 |
【探究活动二】合作小组探究固体样品中是否含有氢氧化钠,设计了如下实验:
| 实验步骤 |
实验操作 |
实验现象 |
结论 |
| 1 |
取无色滤液乙,加入碳酸钠溶液 |
无明显现象 |
无色滤液乙中一定不含氯化钡 |
| 2 |
取适量无色滤液乙,加入过量的 溶液,过滤 |
生成白色沉淀 |
无色溶液中一定含有碳酸钠 |
| 3 |
取实验步骤2中的滤液,滴加 溶液 |
|
原固体样品中一定存在氢氧化钠 |
【反思】实验步骤2中加入过量试剂的目的是 。
【结论】通过两个小组的共同探究,得出了原固体样品中含有的成分。
已知A、B、C、D、E、F、G、H、I均为初中化学常见的物质。其中C、H为常见金属,C是目前世界上产量最高的金属,H呈紫红色;E、F的组成元素相同;I是地壳中含量最高的元素所形成的常见气体单质;人体胃液中含有A,可帮助消化。根据如图所示的转化关系,回答下列问题(图中反应条件均已略去,反应物和产物均已给出)。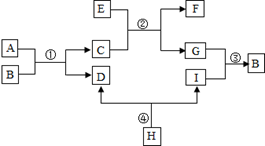
(1)D的名称是 ,(2)写出反应④的化学方程式 ,(3)图中②的基本反应类型是 。
(关于第17题图的修改说明:原图中E改C,C改D,D改E,H改F,F改G,G改H)
将6.8 g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算
⑴生成氢气的质量 。
⑵锌粒中所含锌的质量分数(精确到0.1%)。(Zn-65 H-1)
有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行如下探究。请完成表中空白。
| 实验操作 |
实验现象 |
实验结论及分析 |
| I.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 |
粉末部分溶解,得到白色滤渣和无色滤液 |
滤渣中一定含有 |
| Ⅱ.向滤液中粉末部分溶解,得到白色滤渣试液 |
溶液变红 |
滤液中可能含有 物质(填“酸性”、“碱性”或“中性”) |
| Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 |
|
原固体粉末中一定含有Na2CO3 |
【实验二】乙组同学进行如下探究。
实验测得固体B中含15 g氯元素。
试综合甲、乙两组同学的实验进行分析,填空。(C-12 O-16 Na-23 Cl-35.5)
⑴乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑
⑵该固体粉末的组成可能是 。.
(6分)课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) |
25.0 |
| 蒸发皿+食盐溶液(g) |
45.0 |
| 蒸发皿+食盐晶体(g) |
27.4 |
| 数据处理 |
溶液的溶质质量分数为 |
若化学方法测定结果准确,则物理方法测定结果产生误差的原因是
A.蒸发时未用玻璃棒搅拌 B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热 D.实验后未将玻璃棒上的白色固体移入蒸发皿
(4分)下图中,甲是氧化物,其中金属元素质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为 、
;试剂B是 (填化学式)溶液;反应③的发生需要氧气和水,其化学方程式 。
试题篮
()