科学家提出工业生产回收利用空气中CO2的构想:把空气吹入饱和碳酸钠溶液中,溶液可吸收CO2生成碳酸氢钠;加热碳酸氢钠固体又分解放出CO2;在合成塔内CO2与氢气反应生成甲醇(CH3OH)和水。简要的生产流程如下图所示:
[资料卡片] 碳酸氢钠分解温度是270℃,碳酸钠在856℃熔化,但还未达到分解温度。
请回答下列问题:
(1)吸收池中发生了化合反应,化学方程式为 。
(2)回收利用空气中的CO2,降低大气中CO2浓度,有利于减缓 。
(3)合成塔中发生反应的化学方程式为 。
(4)该流程中能循环利用的物质是 (填化学式)。
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、
饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量 、过量 、过量Na2CO3溶液;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是
。(任写一个)
市售的"自热米饭"带有一个发热包,遇水后可迅速升温至150℃,保温时间达3小时,能将生米做成熟饭。梧州市某中学化学兴趣小组对发热包非常感兴趣,进行了以下探究。
【查阅资料】
(1)发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成。
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液。
【成分探究】取出某品牌的发热包内灰黑色的固体粉末,分成两份。
(1)小吴用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有 。用磁铁将该物质全部吸出后,剩余粉末为样品A。
(2)小周将另一份粉末加水溶解、过滤后,取部分滤液滴入酚酞试液,滤液变 色,证明原粉末中含生石灰;再向滤液中加入 ,看到白色沉淀生成,证明原粉末中含有氯化钠。
(3)除上述物质外,还可能存在镁粉、铝粉、炭粉,对此大家提出了以下几种猜想:
猜想一:只存在上述三种中的一种;
猜想二:上述三种同时存在;
猜想三:存在铝粉和炭粉;
猜想四:存在镁粉和铝粉;
猜想五: 。
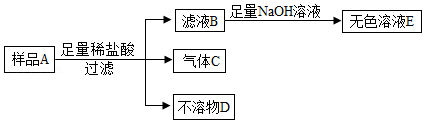
【实验验证】小施用样品A进行实验,流程如下。向滤液B滴加氢氧化钠溶液时,他观察到开始时有白色沉淀生成,后来又全部消失,最后得到的是无色溶液E。
【实验结论】
不溶物D是 。
大家结合实验现象讨论后,认为猜想 正确,理由是 。
【原理探究】
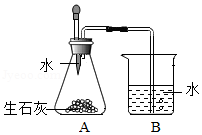
小吴利用如图装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡产生,该气体为 (填名称)。但温度很快下降,说明该反应很快结束,不能长时间保温。
【猜想】大家大胆猜测应该还有其他放热反应存在。
【实验验证】
同学们按资料介绍,用铁粉、炭粉和食盐水在锥形瓶中模拟铁的锈蚀实验,不久后发现锥形瓶外壁微烫,并持续较长时间。该现象很好地解释了发热包的保温机理。
【拓展活动】
在上述铁的锈蚀实验中未观察到红色的铁锈产生。老师告诉同学们,铁锈蚀时首先生成一种碱。请写出该反应的化学方程式 。
“厨房化学”可理解为利用家庭生活用品来进行化学实验,从而对化学进行学习和探讨活动。下列实验不能在“厨房化学”中完成的是
| A.探究铁制品在什么条件下生锈 | B.蛋壳能否溶于酸 |
| C.鉴别食盐和纯碱 | D.检验自来水是否含氯离子 |
下面是某兴趣小组同学做的2个小实验。根据实验内容回答下列问题(仪器的固定装置已经省略)。

(1)若甲中盛有二氧化锰,连接甲乙装置,关闭K1打开K2,从分液漏斗向甲中加入适量双氧水,关闭分液漏斗活塞,观察到乙中导管口有气泡冒出,白磷不燃烧;关闭K2打开K1,则乙中的现象是 ,且白磷燃烧。
①甲中发生反应的化学方程式是 。
②实验过程中,白磷产生现象差异的原因是 。
(2)若甲中充满二氧化碳(K1、K2关闭),连接甲丙,从分液漏斗向甲中加入适量的澄清石灰水,关闭分液漏斗活塞,一段时间后,打开K1,整个实验过程中观察到甲中的现象是 。
有一瓶气体,可能由O2、CO、CO2中的一种或几种组成为确定其组成,在老师的指导下,实验小组对该瓶气体进行了如下探究:
【查阅资料】脱氧剂(还原铁粉能够吸收氧气和水蒸气)。
【实验设计】用如图所示的装置进行实验(已略去夹持装置)。

【实验步骤】①检查装置气密性;②通入一定量氮气;③通入该气体,点燃酒精灯。
【实验现象】步骤③实验过程中,A装置无现象,B和F装置出现白色沉淀,E装置中出现光亮的红色物质。
【实验结论】该气体由 组成。
【实验反思】
(1)C装置的作用是 。
(2)步骤②通入一定量氮气的目的是 。
(3)E装置中氧化铜粉末发生反应的化学方程式为 。
小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
某同学为探究碳在氧气中不完全燃烧的气体产物中,既可能有一氧化碳,又可能有二氧化碳,他设计了如图所示实验:
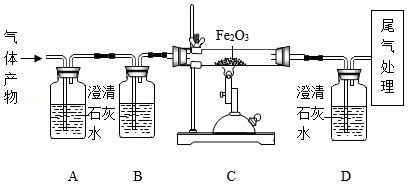
(1)装置A的作用是 。
(2)实验过程中,观察到装置C中玻璃管里的红棕色粉末逐渐变黑,说明原气体产物中含有一氧化碳,反应的化学方程式是 。
(3)通过观察装置D中澄清石灰水变浑浊,也能验证原气体产物中一氧化碳的存在,则装置B中应选择的试剂是 。
A.足量的氢氧化钠浓溶液
B.浓硫酸
C.水
(4)写出尾气处理的一种方法: 。
如图所示,某实验小组的同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、从微观角度分析,中和反应的实质是 。
Ⅱ、探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想①:可能是NaCl和NaOH;
猜想②:可能只有NaCl;
猜想③:可能是 。
【查阅资料】氯化钠溶液呈中性。
【进行实验】
| 实验方案 |
实验操作 |
实验现象 |
实验结论 |
| 方案一 |
取少量烧杯内溶液于试管,滴入几滴酚酞溶液,振荡 |
溶液 色 |
猜想①不正确 |
| 方案二 |
取少量烧杯内溶液于另一支试管 中,逐滴加入碳酸钠溶液至过量 |
|
猜想②不正确,猜想③正确 |
方案二发生反应的化学方程式是 。
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)。
A.pH试纸
B.铜
C.紫色石蕊溶液

某固体粉末可能含有氯化镁、硫酸钠、硝酸钠、硫酸铜和碳酸钙中的一种或几种,为确定其成分,某化学实验小组同学进行了如下实验。
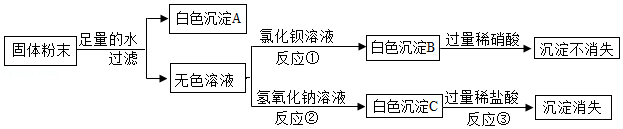
回答下列问题:
(1)白色沉淀C是 (填化学式)。
(2)反应①的化学方程式为 。
(3)原固体粉末中一定含有的物质是 (填化学式),一定不含的物质是 (填化学式)。
某固体粉末可能含有KOH、K2CO3、K2SO4中的一种或几种,为了确定其成分,进行如下实验: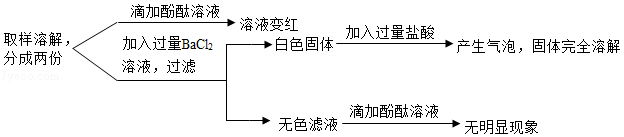
根据上述实验,回答下列问题:
(1)上述实验中,“产生气泡”的化学方程式为 。
(2)分析实验现象,推断原固体粉末的成分是 (填化学式)。
(3)能区别K2CO3溶液和NaCl溶液的试剂是 (填标号)。
A.NaOH溶液
B.盐酸
C.酚酞溶液
D.NaNO3溶液
菠菜中含有一种有机物﹣草酸,将草酸隔绝孔空气加热,使其完全分解,生成水和碳的氧化物,为了探究上述反应生成的碳的氧化物成分,某同学设计了如图所示实验,下列说法不正确的是( )

| A. |
乙装置对实验结果不产生影响,因此可以去掉乙装置以简化实验方案 |
| B. |
丙装置玻璃管中若发生化学反应,则一定为置换反应 |
| C. |
若甲试管内溶液变浑浊,丁试管内无明显现象,则该碳的氧化物成分为二氧化碳 |
| D. |
若甲试管和丁试管内溶液都变浑浊,丙处玻璃管内的红色固体变成黑色,则该碳的氧化物成分为一氧化碳和二氧化碳 |
有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
步骤Ⅰ:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤Ⅱ:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤Ⅲ:取步骤Ⅱ所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)步骤Ⅱ中溶液的红色褪去,发生反应的化学方程式是 。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是 。
(3)若要进一步确定样品的组成,还需进行的实验操作是 。
实验室欲配制1 000 g溶质质量分数为4%的氢氧化钠溶液。请回答下列问题;
(1)配制步骤
①计算:需氢氧化钠固体 g,水 mL(水的密度是1 g/cm3)。
②称量:用质量为23.1 g的烧杯作称量容器,托盘天平上称取氢
氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘。
③溶解:将氢氧化钠固体溶于水,用——搅拌,使氢氧化钠全部溶解,冷却至室温。
④装瓶:把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
请在装有所配制溶液的试剂瓶(见右图)标签上标明相应的信息。

(2)在配制过程中,导致溶液中氢氧化钠质量分数小于4%的可能原因是( )
①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘称取氢氧化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数;④盛装溶液的试剂瓶用蒸馏水润洗;⑤氢氧化钠固体不纯。
| A.①②③④⑤ | B.只有①②④⑤ | C.只有①②⑧ | D.只有②③④⑤ |
(3)若老师提供的药品有500 g 8%的氢氧化钠溶液,500 g 1%的氢氧化钠溶液,足量的氢氧化钠固体和水,除了上述配制方案外,你还可以设计出哪些配制方案,请你写出其中的一种: (只要说明配制时所需的各种药品及用量即可)。
试题篮
()