实验室配制质量分数为6%的NaCl溶液,除托盘天平、玻璃棒、药匙、量筒、胶头滴管外,还需要的仪器是( )
| A. |
烧杯 |
B. |
酒精灯 |
C. |
铁架台 |
D. |
蒸发皿 |
如图是实验室常用的一些仪器。
(1)根据以下实验要求,选择图中合适仪器,将对应的字母填在相应的横线上。
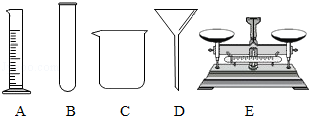
①用固体氯化钠配制50g溶质质量分数为10%的氯化钠溶液 ;
②过滤粗盐水 。
(2)除了图中的仪器,(1)中的①、②两个实验都还要用到的一种仪器是 (填仪器名称)。
(3)若(1)中的①实验配制的氯化钠溶液溶质质量分数偏小,请你分析可能的原因是 (写一条即可)。
某同学欲配制100g溶质质量分数为5%的氯化钠溶液,请回答下列问题:
(1)需称量氯化钠 g,量取水时选择 (填“50mL”或“100mL”)的量筒。
(2)若配制的溶液溶质质量分数大于5%,可能的原因是 。
A.量取水的体积时,俯视凹液面最低处读数
B.装瓶时溶液洒落
C.使用了生锈的砝码
D.溶解时用的烧杯刚清洗过,内壁有水珠
在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
水是一种常见的溶剂,也是重要的资源。
(1)实验室用NaCl固体配制50g 15% NaCl溶液。
①使用托盘天平称取 g NaCl固体。
②溶解过程中需要用到的玻璃仪器有烧杯、量筒、胶头滴管和 (填仪器名称)。
(2)大多数天然淡水需要经过处理方可直接饮用。
①工厂锅炉长期使用会形成水垢,可用盐酸去除。写出水垢中Mg2(OH)2CO3溶于盐酸时发生反应的化学方程式 。
②某家用净水机工作原理如图所示:
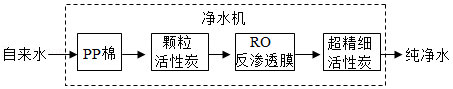
净水机中,PP棉净水原理是 (填“过滤”或“蒸馏”)。颗粒活性炭可去除异味和余氯,是因为活性炭具有良好的 性。
(3)扬州积极推进水环境整治,建设“秀美瘦西湖,文明新扬州”。
①环保部门对水质进行长期监测,将水质从“优”到“劣”分为I~V类。由如图可知,近年来扬州市Ⅱ~Ⅲ类优良水质百分比明显呈 (填“上升”或“下降”)趋势。由此推断,扬州市主要水域的水质在 (填“变好”或“变差”)。

②产生这种变化趋势的原因可能是 (填字母)。
A.夜间排放工业污水
B.清理污染河道的淤泥
C.关停或整改存在污染隐患的企业
(4)污水未经处理直接排入河流,会使水面上藻类物质大量繁殖,水质恶化。某藻类含化学式为C106H263O106N16P的物质,则污水中导致藻类生长过快的营养元素是 (填元素名称)。
实验室用氯化钠和水配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.实验步骤:计算、量取、溶解、装瓶、贴签
B.量取水时,用规格为50mL的量筒
C.实验过程中玻璃棒搅拌的作用是散热
D.若在量取水时俯视读数量取,则配制溶液的溶质质量分数小于6%
国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,75%酒精可有效灭活病毒。现用95%的酒精配制75%的酒精,一般不会用到的仪器是( )
A. B.
B. C.
C. D.
D.
下列是初中化学常见的实验。请回答下列问题
(1)图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是 (答出一条即可)。
(2)图B所示实验观察到木屑先燃烧,燃烧的顺序说明燃烧的条件之一是 。
(3)图C所示实验不能验证质量守恒定律的原因是 。
(4)配制一定质量分数的氯化钠溶液,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质的质量分数 (填“偏大”、“偏小”或“不变”)。
2021年“世界水日”的主题为“珍惜水、爱护水”。
(1)2021年5月10日,“南水北调东线北延应急供水工程”启动向天津等地供水,以缓解我市可利用淡水资源 的现状。
(2)下列有关保护水资源的说法正确的是 (填序号)。
A.生活污水可直接排放
B.工业上对污染的水体作处理使之符合排放标准后再排放
C.农药、化肥的施用会造成水体污染,应该禁止施用
(3)如图是利用海水提取粗盐的过程。

根据海水晒盐的原理,下列说法正确的是 (填序号)。
A.进入贮水池中的海水,氯化钠的质量逐渐减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.析出晶体后,母液中的氯化钠溶液达到饱和
(4)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为 g。
②配制过程有以下步骤:a.称量及量取b.计算c.溶解d.装瓶贴标签,正确顺序是
(填序号)。
A.bcad
B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水 g。
(5)为研究水的组成,某同学进行了电解水实验。
①电解水的化学方程式为 ;
②电解水的实验证明水是由 元素组成的。
在实验室里,用溶质质量分数为6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,回答下列问题:
(1)需溶质质量分数为6%的氯化钠溶液的质量为 g;
(2) 若用量筒量取水时仰视读数, 而其它操作均正确, 则所得溶液中溶质质量分数 (选填“大于”“小于”或“等于”)3%;
(3)混匀时用到的玻璃仪器有烧杯、 。
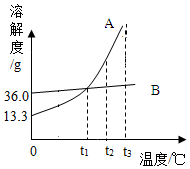
如图是A、B两种物质的溶解度曲线。
(1)0℃时,B的溶解度是 g;t1℃时,A、B的溶解度(S)的大小关系为:SA SB(填“>”、“=”或“<”)。
(2)现有t2℃的A、B的饱和溶液各100g,同时将两份溶液升温至t3℃(不考虑水的蒸发),则此时A、B两溶液的溶质质量分数(a)的大小关系为:ωA ωB(填“>”、“=”或“<”)
(3)现有t2℃的B的溶液100将其蒸发掉10g水,再将温度恢复到t2℃时,析出3gB.若继续蒸发掉10g水,仍将温度恢复到t2℃,此时析出B的质量 3g(填“>”、“=”或“≥”)。
(4)当A中混有少量的B时,提纯A采用的方法是 (填“蒸发结晶”或“降温结晶”)。
(5)现将经提纯的A用于配制一定溶质质量分数的溶液,实验中用到的仪器除了托盘天平(含砝码)、纸片、药匙、烧杯、玻璃棒、试剂瓶、标签外,还需用到的仪器有 。
请回答下列问题:
(1)现提供下列实验仪器和装置:

①实验室用高锰酸钾制氧气,反应的化学方程式为 ;该实验可选用F和 (填序号)组装成排水法收集氧气的装置;还可用 方法收集氧气。
②实验室用锌粒和稀硫酸制氢气,反应的化学方程式为 ;为达到控制反应生和停止的目的,发生装置应选择A和 (填序号);为除去氢气中的水分,用B、C组装成一套装置,向B中加入液体试剂 ,气体通过此装置达到目的。
(2)实验室用氯化钠固体配制50g溶质质量分数为15%的氯化钠溶液。
①量取水,应选择 (填“10mL”或“50mL”)量筒。
②下列操作导致氯化钠溶液的溶质质量分数偏大的是 (填序号)。
a.取用潮湿的氯化钠
b.称量时,所用砝码表面已生锈
c.量取水时仰视读数
d.转移溶液后,烧杯内还有少量氯化钠固体
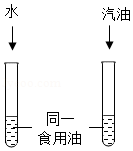
生活生产中,一种或几种物质分散到水等物质里的现象广泛存在。
(1)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是 (填“相同”或“下半部分高”)。
(2)用氯化钠固体和蒸馏水配制50g 15%的氯化钠溶液时,不需要的仪器是 (填“天平”“烧杯”或“蒸发皿”)。
(3)常温下,某同学为探究同一物质在不同溶剂中的溶解性不同,设计了如图所示的实验装置,实验时除了要控制温度相同、试管大小规格相同、加入水与汽油的体积相同外,还要控制食用油的 相同。
(4)事实证明,CaCl2溶于水时能全部解离为自由移动的Ca2+和Cl﹣,若某CaCl2溶液中的Ca2+为a个,则应对的Cl﹣为 个。
2020年新冠肺炎病毒全球肆虐,中华儿女全民战“疫”,彰显中国力量!
(1)合理膳食可以增强人体免疫力。小明用青椒、花生油、鸡蛋、馒头、富硒酱油等食材为家人准备午餐。上述食材中富含蛋白质的是 。硒元素具有防癌抗癌的作用,人体缺硒可能引起表皮角质化和癌症,但摄入量过高又会使人中毒。由此,请你谈谈不能滥用保健品的原因 。
(2)酒精是本次防疫常用的消毒剂。酒精(C2H6O)由 种元素组成,它属于 (填“有机物”或“无机物”)。喷洒酒精溶液消毒时遇明火容易引起火灾,其原因是 (填字母序号)。
A.“喷洒”降低了酒精的着火点
B.“喷洒”使空气中混有大量的酒精分子
C.“喷洒”使酒精分子的体积变小了
(3)0.5%的过氧乙酸溶液也是一种高效消毒剂。现有10%的过氧乙酸溶液250g,可配制0.5%的过氧乙酸溶液的质量是 g。
碳酸钠俗称纯碱或苏打,在生活、生产和实验研究中均有广泛应用。
[配制溶液]配制溶质质量分数分别为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是 (填字母)。
a.用托盘天平称取2g Na2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 |
Ⅰ |
Ⅱ |
III |
溶质质量分数 |
1% |
2% |
4% |
溶液pH |
11.62 |
11.76 |
11.90 |
分析Ⅰ、Ⅱ、Ⅲ三组数据可得出的结论是 。
[制备物质]用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
[已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀]
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是 (填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:4FeCO3+6H2O+O2═4X+4CO2.则X的化学式为 。
[标定浓度]标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于lg•mL﹣1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将 (填“偏大”、“偏小”或“无影响”)。
试题篮
()