《四川盐法志》记载,“敞锅熬盐”主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(1)步骤①中,黄卤所含杂质BaCl2和黑卤所含杂质MgSO4反应生成白色沉淀。该反应的化学方程式为 。
(2)步骤②中,析出粗盐的过程称为 。
(3)步骤③用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl.则“花水”应当是 (填标号)。
A.蒸馏水 B.饱和NaCl溶液 C.饱和NaOH溶液 D.饱和BaCl2溶液
(4)将60kg含10%NaCl的黄卤和40kg含15%NaCl的黑卤混合,经“敞锅熬盐”制得的粗盐中NaCl的质量最多为 kg。
Ba(NO 3) 2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO 3、BaSO 3、Fe 2O 3)可制取Ba(NO 3) 2,其部分流程如图:
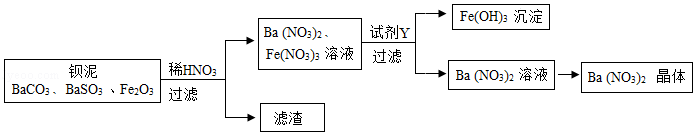
(1)Ba(NO 3) 2中钡元素的化合价为 ;流程中所涉及的氧化物是 (填1种即可)。
(2)BaCO 3与稀HNO 3反应的反应类型是 ;写出Fe 2O 3与稀HNO 3反应的化学方程式: 。
(3)试剂Y为 (填序号)。
①BaCl 2溶液 ②Ba(OH) 2溶液 ③NaOH溶液
(4)从Ba(NO 3) 2溶液中析出Ba(NO 3) 2晶体的方法是 。
甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( )

| A. |
t 2℃,所得溶液都是饱和溶液 |
| B. |
t 1℃时,向50g水中加入甲可得80g饱和溶液,则乙在该温度下的溶解度为60g |
| C. |
甲中混有少量乙时,可用降温结晶的方法提纯甲 |
| D. |
t 2℃时,将等质量的甲、乙两种溶液分别降温到0℃,甲溶液的溶质质量分数一定小于乙溶液的溶质质量分数 |
2017年,联合国把世界水日的主题定为"废水",关注重点是寻找各种方式来减少和再利用废水。以下对不同工业废水的处理措施及对应的方法类别,都正确的是( )
| 选项 |
废水中的主要污染物 |
处理措施 |
方法类别 |
| A |
不溶性颗粒物 |
加明矾 |
结晶法 |
| B |
异味物质 |
加活性炭 |
吸附法 |
| C |
氯化铜 |
加硫酸钠 |
过滤法 |
| D |
纯碱 |
加石灰水 |
蒸馏法 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
某校举行科学实验操作考查,由学生抽签确定考察的实验内容,要求根据提供的实验器材完成相关实验。
(1)A组实验有:①过滤含泥沙的食盐水;②蒸发氯化钠溶液获得晶体;③用实验室方法制取一瓶二氧化碳,甲同学抽到的是A组中的一个实验,需要如下器材:
则他抽到的实验是 (选填序号)。
(2)乙同学抽到的是B组中的一个实验:配制50克10%的氯化钠溶液,为完成该实验,他应称取固体氯化钠 克。
(3)丙同学抽到的是B组中另一个实验:验证硫酸和氢氧化钠溶液的酸碱性,用到的试剂有:稀硫酸、氢氧化钠溶液、紫色石蕊试液。实验结束后,他将实验后的溶液全部倒入废液缸,混合溶液呈蓝色,则混合溶液中除石蕊外还含有的溶质为 (写化学式)

实验室有一瓶由氯化钾和硝酸钾组成的化肥,但标注的质量分数已模糊不清,小明想通过实验重新标注,以下是他进行的实验步骤:
①取10克样品于烧杯中,加入蒸馏水充分溶解,配制成60克溶液;
②在配制的溶液中,加入一定量的硝酸银溶液,恰好完全反应;
③将上述混合液过滤,沉淀经洗涤、干燥后,称得质量为14.35克。
3 3)
(1)在过滤操作中使用的玻璃仪器有:烧杯、 和玻璃棒。
(2)样品中氯化钾的质量分数为多少?(要求列式计算)
(3)完全反应后,混合液中的硝酸钾质量是多少克?
(4)为了回收硝酸钾,小明对滤液进行蒸发、结晶、称量,发现所得的晶体质量小于计算得出的理论值。造成这种结果的原因可能是 。(选填编号)
A.晶体没有干燥
B.蒸发时液体飞溅
C.硝酸钾残留在玻璃棒上
2017年,联合国把世界水日的主题定为“废水”,关注重点是寻找各种方式来减少和再利用废水。以下对不同工业废水的处理措施及对应的方法类别,都正确的是( )
选项 |
废水中的主要污染物 |
处理措施 |
方法类别 |
A |
不溶性颗粒物 |
加明矾 |
结晶法 |
B |
异味物质 |
加活性炭 |
吸附法 |
C |
氯化铜 |
加硫酸钠 |
过滤法 |
D |
纯碱 |
加石灰水 |
蒸馏法 |
A.AB.BC.CD.D
下列除去杂质(少量)的方法中正确的是( )
选项 |
物质 |
杂质 |
除杂方法 |
A |
CaCO3固体 |
CaO |
加足量稀盐酸,过滤 |
B |
O2气体 |
H2O |
通过浓硫酸洗气、收集 |
C |
Cu(NO3)2溶液 |
AgNO3 |
加过量Fe粉,过滤 |
D |
NaCl固体 |
KNO3 |
配成热饱和溶液,降温结晶、过滤、洗涤、干燥 |
A.AB.BC.CD.D
某同学设计的工业制备氢氧化钠的流程如图
1.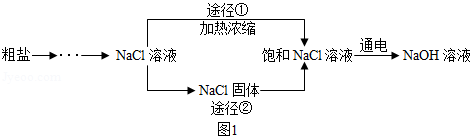
资料:2NaCl+2H2O 2NaOH+H2↑+C12↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+C12↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)晾晒海水得到粗盐的原理是
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和______
(3)工业生产中应选择途径 (“①”或“②”),理由是
(4)Cl2可用于生产84消毒液(有效成分 NaClO),反应原理为:Cl2+2NaOH=NaCl+NaClO+H2O,反应前后氯元素的化合价有 种。
(5)图2实验测定水组成,不能加入NaCl增强水的导电性的理由是 。电解水的化学方程式为 。
(6)图3实验获得84消毒液,直流电源正极应与 (填a或b)连接,才能使 NaClO的含量更高。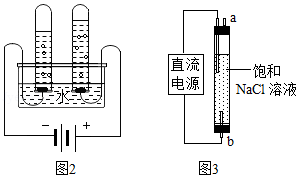
根据下列实验装置或操作示意图回答问题:
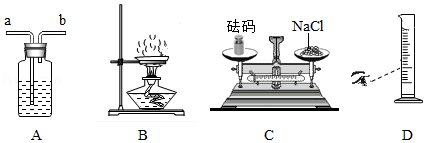
(1)用图A装置干燥O2,广口瓶内盛放的试剂是 ,气体应从 (填“a”或“b”)口进入.
(2)图B是蒸发食盐水操作,缺少的仪器是 ,组装该装置时,放置仪器的先后顺序是 (填数字序号).
①铁架台 ②铁圈 ③蒸发皿 ④酒精灯
(3)配制一定溶质质量分数的氯化钠溶液,图C中称量操作的错误之处是 .若其他操作均正确,按图D所示量取蒸馏水,则配制的氯化钠溶液浓度会 (填“偏大”“偏小”或“无影响”).
下列实验操作正确的是( )
A.用润湿的pH试纸测定稀硫酸的pH
B.过滤时玻璃棒末端斜靠在三层滤纸上
C.在进行粗盐提纯实验时,将盛放滤液的蒸发皿放在石棉网上加热
D.用排水法收集O2时,当导管口出现气泡时立即收集
盐酸、氢氧化钠是常见的酸碱。
(1)盐酸溶液中阳离子符号是 ,氢氧化钠的俗称是 (写一种)。
(2)向稀氢氧化钠溶液中滴入酚酞溶液。当滴入稀盐酸至完全中和时。溶液的颜色变化是 ,取少量中和后的溶液加热蒸干,现象是 。
(3)根据化学方程式计算,含HCl 7.3g的稀盐酸可中和氢氧化钠的质量为多少?
试题篮
()