NaOH、KNO3和Na2CO3在不同温度下的溶解度如下表所示。
温室/℃ 溶解度/g 物质 |
0 |
10 |
20 |
30 |
40 |
NaOH |
42.0 |
51.0 |
109.0 |
119.0 |
129.0 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
Na2CO3 |
6.0 |
16.0 |
18.0 |
36.5 |
50.0 |
下列实验过程中不考虑化学变化、水的蒸发和结晶水合物等因素。
(1)10℃时,KNO3的溶解度 (填“>”、“<”或“=”)Na2CO3的溶解度。
(2)40℃时,将129g NaOH固体加入到100g水中,搅拌后固体全部消失,放置到t1时刻开始析出固体,到t2时刻析出10g固体。
①t1时刻为 (填“饱和”或“不饱和”)溶液。
②t2时刻溶液的温度为 ℃。
(3)40℃时,将等质量的三种物质的饱和溶液冷却到30℃,所得溶液中溶剂质量最多的是 (填序号)。
A.Na2CO3溶液
B.KNO3溶液
C.NaOH溶液
生产生活中,一种或几种物质分散到水等物质里的现象十分常见。
(1)碘酒是固体碘单质分散于酒精中形成的溶液,是一种常用消毒剂,合格的碘酒是澄清透明的。一瓶合格的碘酒密封放置一段时间后, (填“会”或“不会“)出现浑浊现象。
(2)通常状况下下列物质分散于水或空气中所形成的三种体系为:①蛋白质溶液②高锰酸钾溶液③含有直径为2﹣10μm颗粒物的空气,在这些体系中,物质被分散成的粒子或颗粒最小的是 (填序号)。
(3)某同学欲探究物质在水中溶解时会发生的某种变化,设计了如下实验方案:
实验步骤及操作 |
结论 |
1.取一只烧杯,注入约50mL水。 |
/ |
2.向烧杯中加入约5g硝酸铵固体搅拌至固体完全溶解,用温度计测量溶液的温度。 |
硝酸铵溶于水时吸收热量,使溶液温度降低。 |
①该实验的目的是探究物质在溶解过程中 。
②该实验方案的不合理之处是 。
氯化钠具有广泛的用途。

(1)生理盐水中的溶剂是 。
(2)生理盐水标签如图1所示。某同学欲配制标签中所标示的生理盐水一瓶,需要水的质量是 g。
(3)氯化钠主要存在于海水中,海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,如图2是它们的溶解度曲线。分别将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数从大到小的关系是 (填写字母序号)。
(4)某同学利用实验探究NaCl在水中的溶解度,所得数据记录如表。
序号 |
温度 |
水质量 |
加入NaCl质量 |
溶液质量 |
① |
20℃ |
25g |
9g |
34g |
② |
20℃ |
50g |
20g |
68g |
③ |
20℃ |
100g |
34g |
134g |
④ |
20℃ |
150g |
54g |
204g |
上述实验中,所得溶液为饱和溶液的是 (填数字序号)。
用化学知识回答下列问题:
(1)空气的主要成分中,常用作保护气的是 。
(2)水果和蔬菜中富含的可以调节人体新陈代谢、预防疾病和维持身体健康的营养素是 。
(3)天然存在的最硬的物质是 。
(4)将下列食品或调味品分别放入水中,充分搅拌,能形成溶液的是 (填标号)。
A.食盐
B.面粉
C.蔗糖
D.食用油
E.奶粉
氯化钠和硝酸钾的溶解度曲线如图所示,回答下列问题。
(1)A点表示的意义是 ;
(2)在60℃时,向盛有10克水的烧杯中加入15克硝酸钾固体,充分搅拌,溶液质量为 g。

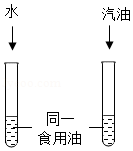
生活生产中,一种或几种物质分散到水等物质里的现象广泛存在。
(1)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是 (填“相同”或“下半部分高”)。
(2)用氯化钠固体和蒸馏水配制50g 15%的氯化钠溶液时,不需要的仪器是 (填“天平”“烧杯”或“蒸发皿”)。
(3)常温下,某同学为探究同一物质在不同溶剂中的溶解性不同,设计了如图所示的实验装置,实验时除了要控制温度相同、试管大小规格相同、加入水与汽油的体积相同外,还要控制食用油的 相同。
(4)事实证明,CaCl2溶于水时能全部解离为自由移动的Ca2+和Cl﹣,若某CaCl2溶液中的Ca2+为a个,则应对的Cl﹣为 个。
下表是通过实验测得两种固体物质在不同温度时的溶解度,如图是市售果味型汽水配料表。请据图回答问题:
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
氯化钾 |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
|
(1)20℃时,氯化钠的溶解度是 g。
(2)40℃时,将50g氯化钾放入100g水中,充分搅拌,所得溶液的质量为 g;
(3)60℃时,将45g氯化钠和45g氯化钾分别放入100g水中充分搅拌,所得氯化钠溶液溶质的质量分数 氯化钾溶液溶质的质量分数(填“<”或“>”或“=”);
(4)打开如图所示果味型汽水瓶盖时,观察到汽水中有大量气泡产生,结合配料成分可知,此时汽水是 的饱和溶液(填配料表中的具体物质)。

溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是 (填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表Ⅰ是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 |
OH﹣ |
Cl﹣ |
CO32﹣ |
SO42﹣ |
K+ |
溶 |
溶 |
溶 |
溶 |
Mg2+ |
不 |
溶 |
微 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
表Ⅰ空格中应填写 ;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是 。
温度 (℃) |
0 |
10 |
20 |
30 |
40 |
氯化钠(g) |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠(g) |
6 |
10 |
18 |
36.5 |
50 |
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理 。
水与我们密切相关,请回答:
(1)自然界中的水属于 (填“纯净物”或“混合物”)。
(2)日常生活中常用 的方法来降低水的硬度。
(3)实验室中常用水作溶剂,下列物质分散在水中能形成溶液的是 (填序号)。
A.泥土 B.蔗糖 C.食用油
(4)工业上用水和甲烷(CH4)在一定条件下反应生成 一氧化碳和氢气。该反应的化学方程式为 。
在野炊活动中,同学们携带了铁桶、牛肉、面条、蔬菜、食用油、食盐、味精、食醋、去污粉(有效成分为碳酸钠)等用品.
(1) 携带过程中,小滨不慎将食盐、去污粉的瓶子混淆了,若将它们重新区分,应选用 (填所携带物品的名称).
(2)小崔生火后在“灶”上悬挂铁锅时,小心调节铁锅到合适的高度,这样做的原因可能是 (填字母序号):
A.使用焰心加热 B.使用内焰加热 C.使用外焰加热
(3)烹饪牛肉汤时,为了解汤的咸味.小秀同学取锅中少量汤品尝,取少量汤进行品尝就可知道整锅汤咸味如何,是因为溶液具有 (填一条性质).
(4)野炊结束时,小俊用干布抹去铁锅表面的水渍,这样的目的是 .
豆腐是客家美食之一.豆腐制作过程如下:
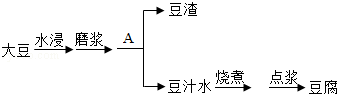
根据要求回答问题:
(1)豆浆 (填"是"或者"不是")溶液.
(2)"点浆"是使用MgCl 2、CaSO 4等凝固剂使豆浆凝固的过程.这些凝固剂的水溶液能导电,说明它们在水中溶解时能生成 .
(3)操作A为 .在实验室进行此操作,用到的玻璃仪器有烧杯、玻璃棒和 .
(4)食用豆腐有益于补充人体所需的蛋白质、预防骨质疏松症等.
①蛋白质对生命活动的重要意义是 ;
②豆腐能够预防骨质疏松症,说明豆腐含较丰富的 (填元素名称).
(5)豆腐中某成分会促进人体内碘的排泄.因此,食用豆腐时,可和 (填一种食物)搭配,解决食用豆腐可能引发的碘流失.
水是生命之源,人类的日常生活和工农业生产都离不开水。
(1)下列物质加入水中能形成溶液的是 (填字母序号)。
A.食盐 B.面粉 C.植物油
(2)向某水样中加入肥皂水,搅拌,若观察到 的现象,则水样为软水。
(3)如果工业废水中含有酸性物质,应该用 性物质处理后再排放。
(4)下列做法会造成水污染的是 (填字母序号)。
A.生活污水处理后再排放
B.合理使用农药和化肥
C.任意排放工业废水
(5)市售“自热米饭”的自热原理是:让饭盒夹层中的水与生石灰接触、反应并放出大量的热。该反应的化学方程式是 。
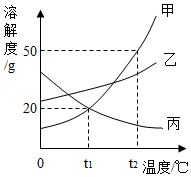
水和溶液在生产、生活中有着重要的作用.
(1)生活中常用 的方法降低水的硬度
(2)下列物质在水中不能形成溶液的是 (填序号)
A.白糖 B.汽油 C.食盐 D.高锰酸钾
(3)甲、乙、丙三种固体物质在水中的溶解度曲线如图所示.
①随温度升高,溶解度减小的物质是
②t1℃时,分别向100g水中加入20g甲和20g乙,能形成饱和溶液的是
③下列有关叙述正确的是 (填序号)
A.t2℃时,甲的饱和溶液中溶质的质量分数为50%
B.分别将甲和乙的饱和溶液从t2℃降到t1℃时,析出固体的质量为甲>乙
C.从接近饱和的甲溶液中析出一定量的甲晶体后,剩余溶液的溶质质量分数变小
D.t2℃时,分别将50g甲、乙、丙固体溶于水,配成饱和溶液,需要水的质量为甲<乙<丙.
试题篮
()