如图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中正确的是( )
| A.a的溶解度大于b的溶解度 |
| B.要使t2℃时c物质的不饱和溶液成为饱和溶液可采用降低温度 |
| C.a、b的饱和溶液从t2℃降温至t1℃时,析出的晶体质量是a>b |
| D.t1℃时,60g a的饱和溶液中含有溶剂50g |
温室时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出。对于该溶液下列说法正确的是
| A.溶质的溶解度减小 | B.溶质的质量减小 |
| C.溶质的质量分数减小 | D.溶液变成饱和溶液 |
氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。其中措施正确的是( )
| A.①②④ | B.①③④ | C.①③⑤ | D.①②⑤ |
将0.5 g某物质在20 ℃时溶于10 g水中即达到饱和,则一般把这种物质的溶解性判定为( )
| A.易溶物质 | B.可溶物质 | C.微溶物质 | D.难溶物质 |
下列关于海水晒盐的说法不正确的是( )
| A.结晶池中氯化钠质量分数大于海水中氯化钠质量分数 |
| B.由于水分蒸发,蒸发池中氯化钠质量分数逐渐增大到一定数值 |
| C.母液是NaCl的饱和溶液,也是所含杂质MgCl2、CaCl2的饱和溶液 |
| D.气温高、湿度低、风力大、雨量少、阳光充足有利于海水“晒盐” |
下列关于溶液的说法,正确的是
| A.溶液都是无色透明的 | B.面粉与水混合可形成溶液 |
| C.饱和溶液不能再溶解任何物质 | D.硝酸铵溶解在水中,溶液温度会降低 |
从所给数据分析,下列选项正确的是( )
| 温度/℃ |
10 |
30 |
50 |
60 |
|
| 溶解度/g |
氯化钠 |
35.8 |
36.3 |
37.0 |
37.3 |
| 硝酸钾 |
20.9 |
45.8 |
85.5 |
110 |
A.欲从海水中获得氯化钠,可采用蒸发结晶的方法
B.将50 ℃时的硝酸钾饱和溶液降温到10 ℃,有晶体析出
C.60 ℃时,往100 g水中加入100 g硝酸钾,可得到饱和溶液200 g
D.物质的溶解度均随温度的升高而增大或随温度的降低而减小
x、y两物质(不含结晶水)溶解度曲线如图所示,在t2℃时分别往两份100g水中加入a克x和a克y充分搅拌后,将溶液均降温至t1℃,下列说法正确的是
| A.t1℃时,x、y两溶液均已饱和 |
| B.t1℃时,x、y的溶解度相等,且两溶液质质量分数相等 |
| C.t2℃时,x、y两溶液溶质质量分数相等,且两溶液均已饱和 |
| D.t2℃时,x、y两溶液中溶质质量分数不相等,且两溶液均不饱和 |
右图是a、b、c三种物质的溶解度曲线。把t1℃时三种物质的饱和溶液温度升高到t2℃,则三种溶液的溶质质量分数大小关系是
| A.a>b>c | B.c>b>a |
| C.b>a=c | D.b>a>c |
根据如图所示的溶解度曲线判断,下列说法正确的是( )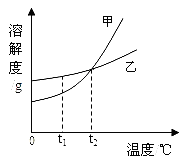
| A.甲物质的溶解度大于乙物质的溶解度 |
| B.甲物质的不饱和溶液温度升高后变成饱和溶液 |
| C.将t2℃甲、乙两物质的饱和溶液温度降低到t1℃时都会析出晶体 |
| D.t2℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有相等质量的溶质 |
为了测定在一定温度时某固体物质的溶解度,待测液必须是该温度下该物质的( )
| A.浓溶液 | B.稀溶液 | C.不饱和溶液 | D.饱和溶液 |
将一定温度下的某物质的不饱和溶液转变为饱和溶液,下列方法一定能成功的是
| A.降温 | B.升温 | C.加入溶质 | D.蒸发溶剂 |
甲、乙两种固体物质的溶解度曲线如下图所示。下列叙述正确的是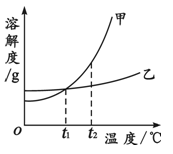
| A.t1℃时,甲和乙溶液中溶质的质量分数一定相等 |
| B.t2℃时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲 |
| C.将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数比乙大 |
| D.用降温的方法一定能使甲的不饱和溶液变成饱和溶液 |
试题篮
()