溶液在生产和生活中有重要意义。
(1)某兴趣小组为了研究物质的溶解和结晶,做了如下所述过程的实验:
小资料:氯化钠和硝酸钾的溶解度数值:
| 项目 |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
70℃ |
| NaCl |
35.8g |
36.0g |
36.3g |
36.6g |
37.0g |
37.3g |
37.8g |
| KNO3 |
20.9g |
31.6g |
45.8g |
63.9g |
85.5g |
110g |
138g |
①物质A是 (填“氯化钠”或“硝酸钾”)
②状态“④”时,物质A 溶解(填“部分”或“全部”)
③上述实验过程中所得溶液达到饱和的是_______(填数字序号,下同);溶质质量分数最大的是 。
下表是KNO3、NaCl在不同温度下的溶解度(单位:g):
| 温度(℃) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| KNO3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
| NaCl |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
(1)以上两种物质溶解度的变化受温度影响较小的是 。
(2)20℃时,食盐饱和溶液中溶质的质量分数是 。(保留一位小数)
(3)用上表数据来画溶解度曲线,两种物质的曲线相交时的温度范围应是 。(填字母序号)
A.10~20℃ B.20~30℃ C.30~40℃ D.40~50℃
(4)70℃时,将138gKNO3、37gNaCl分别溶解在各装有100g水的两个烧杯中,其中能形成饱和溶液的是 ;若从70℃降到20℃后,下列说法中正确的是 (填字母序号)。
A.KNO3析出,NaCl不析出
B.其溶剂的质量不变
C.KNO3和NaCl的质量分数都降低
D.KNO3的质量分数降低,NaCl的质量分数不变
下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 。
(2)t1℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗? (填“能”或“不能”)。
(3)t2℃时,a、b、c三种物质的溶解度按由大到小的顺序排列的是 。
.氯化钾和硝酸钾晶体在不同温度时的溶解度如下表所示。
(1)30℃时KNO3的溶解度为 g。
(2)若两物质的溶解度相等,此时所对应的温度范围在 之间。
(3)在20℃时,将35gKCl加入到100g水中,形成的KCl溶液的质量为 g,将温度升到40℃,形成的溶液 (选填“饱和”或“不饱和”)溶液。
(4)下图中能表示KCl溶解度曲线的是 (选填“a”或“b”)。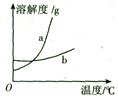
下列数据是氯化钠和氯化铵固体在不同温度时的溶解度。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g NaCl |
35.7 |
36.0 |
36.6 |
37.6 |
38.4 |
39.8 |
| NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.5 |
77.3 |

医疗上,氯化钠常用于配制0.9%的生理盐水,生理盐水中溶质为________。
从海水中提取食盐通常采取晾晒海水的方法,这是因为随温度升高氯化钠的溶解度变化 ________(填“大”或“小”)。
20℃时,向100 g水中加入25 g氯化钠,充分溶解后,溶液中溶质质量分数为 ________。
现有200 g溶质质量分数为10%的氯化钠溶液,若使溶液的溶质质量分数增加一
倍,应该蒸发掉 ________g水。30℃时,向两个分别盛有相同质量的氯化钠和氯化铵的烧杯中,各加入100 g水,充分溶解后,恢复至30℃,其结果如右图所示。有关下列说法中,正确的是________(填字母序号)。
| A.烧杯②中溶液是不饱和溶液 |
| B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解 |
| C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小 |
| D.将得到的烧杯②中溶液降温至0℃时,溶液中溶质质量分数一定减小 |
下图为a、b、c三种固体物质的溶解度曲线。请根据图示回答:
(1)t1℃时,100 g水中加入100 g 的a物质充分溶解后可以得到
g的a溶液。
(2) 将t2℃时的a、b、c三种物质的饱和溶液温度降至t1℃时,所得三种溶液的溶质质量分数由大到小依次为 。(填序号)
(3)从图中你还能得到什么信息?(任填一条)___________。
(5分)右图是A.B.C三种物质的溶解度曲线,据图回答:
(1) t1℃时A.B.C三种物质的溶解度由大到小的顺序是 (填写序号)。
t1℃时A.B.C三种物质的溶解度由大到小的顺序是 (填写序号)。
(2)M点表示的意义是 。
(3)t1℃时30gA物质加入到50g水中不断搅拌形成的溶液质量是 g。
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由小到大的关系是 。(填写序号)
(5)当A中混有少量的B时,要提纯A应采用的方法是: 。(填“冷却结晶”或“蒸发结晶”)
5分)右图是A.B两种固体物质的溶解度曲线。请回答下列问题:
(1)温度为 ℃时,A.B饱和溶液中溶质的质量分数相等;
(2)t2℃时,将60g A物质放入100g水中,充分搅拌,所得溶液的
质量是 g,所得溶液的溶质质量分数是 。
(3)将接近饱和的A物质的水溶液,变成饱和溶液的方法有 、 。
下图是A、B两种固体物质的溶解度曲线。请回答下列问题: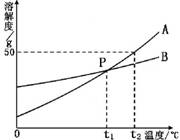
(1)P点的意义是 。
(2)将接近饱和的A物质的水溶液,变成饱和溶液的方法有 (答出一种即可)。
(3)t2℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是 g。
如图所示:甲、乙两种固体物质的溶解度曲线,请回答:
(1)将30℃时等质量的甲、乙饱和溶液分别降到10℃时,析出溶质最多的是
(2) ℃时,甲的溶解度大于乙的溶解度;
(3)30℃时,甲的饱和溶液中溶质、溶剂和溶液的质量比为
如图是a、b、c三种固体物质的溶解度曲线。
(1)点P表示______________________________。
(2)当温度为t2℃时的a、b、c三种物质的溶解度由大到小的顺序________。
(3)要使接近饱和的c物质的溶液变为饱和溶液,可采取的一种措施是_______________________。
(4)t2℃时,50g水中最多能溶解 a物质________ 。
分析与填空(先在A、B、C中选择一个正确选项填在相应的括号里,然后在D处再补充一个符合题意的答案。)
(1)混合物中含有多种物质。日常生活中的下列物质,属于混合物的是( )
A.氧气 B.蒸馏水 C.加碘食盐 D.
(2)合金是由一种金属和其他金属(或非金属)熔合形成的有金属特性的物质,它们比纯金属的应用更加广泛。下列物质属于合金的是( ) A.铜 B.黄铜 C.赤铁矿 D.
(3)固体物质的溶解度受很多因素的影响。下列因素中影响固体溶解度的是( )
A.溶解时搅拌 B.溶剂的性质 C.固体的颗粒大小 D.
(毎空1分,共4分)下图是a、b、c三种物质的溶解度曲线。 
(1)在 ℃时,a、c两种物质的溶解度相等。
(2)在t2℃时,向三只烧杯中各装入50g水,分别充分溶解三种物质a、b、c,其中溶解最多的物质是 。
(3)将t2℃时a、b、c三种物质饱和溶液的温度降低到t1℃时,三种溶液的溶质质量分数由大到小的关系是 (填序号)。
(4)从图中我还能得到的信息有 (写一条)。
试题篮
()