(5分) 20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题: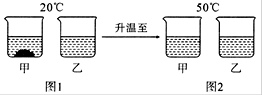
(1)图1中可能为饱和溶液的是 。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为 。
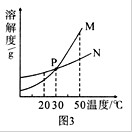
(3)图3中表示乙的溶解度曲线是 ;P点表示的含义是 。
(4)50℃时,将甲物质的不饱和溶液变为饱和溶液,可采取的方法是 。(填三种方法,用分号隔开)
如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
(1)随着温度的升高其溶解度减小的是_____;在____℃时,甲与丙的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为_______________。
(3)t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是__________(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示)。
根据下表回答问题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 (g/100g水) |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
| KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
⑴ 40℃时,氯化钠固体的溶解度是 g/100g水。
⑵ 60℃时在100g水中加入100g硝酸钾固体,充分溶解后所形成的溶液是 溶液(“饱和”或“不饱和”)。
⑶ 将上述⑵中溶液降温到20℃时,析出的晶体质量是 g.
⑷ 工业上将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温,析出晶体。
①析出的晶体中主要物质是 ;
②关于剩余溶液.下列说法正确的是 (填序号);
A.只含氯化钠,不含硝酸钾
B.含有氯化钠,又含有硝酸钾,且只有硝酸钾达到饱和
C.含有氯化钠,又含有硝酸钾,且两者都达到饱和
⑸ 20℃时,将18克氯化钠溶解在80克水中,应至少蒸发 g 水才能形成饱和溶液。蒸发时要用到玻璃棒,其作用是 。
A.搅拌促进溶解 B.加速蒸发
C.防止液滴飞溅 D.引流缓冲
⑹右图为硝酸钾的溶解度曲线。M、N两点分别表示硝酸钾的两种溶液。下列做法能实现M、N间的相互转化的是 
A.从M→N:先将M升温再将其蒸发掉部分水
B.从M→N:先将M升温再将加入适量固体硝酸钾
C.从N→M:先将N降温再加入适量固体硝酸钾
D.从N→M:先过滤出适量固体硝酸钾再降温
根据右图A、B、C三种固体的溶解度曲线回答:
(1)P点的含义是 。
(2)要使C的饱和溶液成为不饱和溶液,可采用的一种
方法是 。
(3)要从含有少量A的B溶液中得到较多的B晶体,通常采用的方法是 。
(4)t1℃时,将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为 (结果精确至0.1%)。
(5)将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数最小的是 (填序号)。
溶液是生活中常用的混合物。
(1)硫酸铜溶液可用于游泳池消毒,硫酸铜溶液中的溶质是 。
(2)市售的过氧乙酸(CH3COOOH)溶液中溶质的质量分数大多为40%,稳定性差,室温下就可分解成乙酸(CH3COOH),并释放出氧气,该反应的化学方程式为 。将40% 的过氧乙酸溶液稀释成2%,可用于空气消毒, 稀释过程中浓溶液与所加水的质量比为 。
(3)甲、乙两种固体物质的溶解度曲线如图2所示。20 oC时,将等质量的甲、乙分别放入盛有100g水的烧杯中,充分搅拌并升温至50 oC时,实验现象如图1所示。请结合图示回答下列问题:
①曲线N表示 (填“甲”或“乙”)的溶解度随温度变化的情况。
②图1所示的四种溶液中,溶质质量分数最小的是 (填字母序号,下同),一定不饱和的是 。
下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
| 温度 (℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| KNO3 |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)以上两种物质溶解度的变化受温度影响较小的是 。
(2)30℃时,KNO3的溶解度是 g/100g水。
(3)KNO3溶液中含有少量NaCl时,可通过 的方法提纯。
(4)对③析出的晶体和剩余溶液描述正确的是 (填写编号)。
A.剩余溶液一定是KNO3饱和溶液
B.剩余溶液一定是NaCl不饱和溶液
C.上述方法可以将两者完全分离
D.析出的晶体中只含有KNO3
(5)在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。改变温度只使KNO3析出,则温度T(℃)的范围是 (硝酸钾和氯化钠溶解度互不影响)。
右图为氯化钠、碳酸钠在水中的溶解度曲线。请回答下列问题:
(1)氯化钠溶液中的溶质是 ;
(2)10℃时,碳酸钠的溶解度为 g;
(3)30℃时,氯化钠的溶解度 碳酸钠的溶解度(填写“>”、“<”或“=”);
(4)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是 溶液(填化学式);
(5)如右图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,变为不饱和溶液。加入的物质可能是________(填字母序号)。
| A.氢氧化钠溶液 | B.生石灰 | C.硝酸铵 | D.稀硫酸 |
如图表示KNO3和NaCl的溶解度曲线,回答下列问题。
(1)医用生理盐水中,溶剂是 。
(2)t1℃时KNO3的溶解度为______。
(3)图中A点表示的意义是 。
(4)欲从食盐水中得到NaCl,可采用的方法是 。
(5)将t1℃时饱和KNO3溶液升温至t2℃,下列各项保持不变的是 。[填序号]
| A.溶质质量 | B.溶剂质量 | C.溶液质量 | D.溶质质量分数 E. 溶解度 |
(4分)右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么50g水中溶解 g乙,溶液刚好饱和。
(2)t2℃时,比较两物质的溶解度大小: 。
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (写一种即可)。
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是 。
如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
(1)随着温度的升高其溶解度减小的是_____;在____℃时,甲与丙的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为_______________。
(3)t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是__________(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示)。
下图是甲、乙两种物质的溶解度曲线,A、B两个烧杯中分别盛有20 ℃时上述两种物质的饱和溶液。
请回答下列问题:
(1)M点的含义是 。
(2)将乙物质的饱和溶液的转化为不饱和溶液的方法是 。
(3)80 ℃时,甲物质饱和溶液中溶质的质量分数为 。
(4)若甲物质中混有少量的乙,提纯甲物质的方法是 。
(5)当温度由20 ℃升高至60 ℃时(不考虑水分蒸发),
若B烧杯中固体质量增加,则A烧杯中溶液的溶质质量分数 。(填“不变”、“变大”、“变小”)
甲、乙两种物质的溶解度曲线如图。
(1)20℃时,甲物质的溶解度_______g;
(2)20℃时,把50g甲物质放入100g水中,所得的溶液是______________(选填“饱和”或“不饱和”);
(3)欲将40℃时乙物质的饱和溶液变为不饱和溶液,可采用的方法是_________。
和
是重要的盐类物质。其溶液应用广泛。
Ⅰ.(1)
溶液的酸碱性和
溶液相似,能使无色酚酞溶液变色。
(2)
和
在不同温度时的溶解度如下:
| 温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
| 溶解度/g |
|
110 |
114 |
121 |
126 |
139 |
|
|
31.6 |
45.8 |
85.5 |
110 |
169 |
①右图中表示
溶解度曲线的是(填"甲"或"乙")。

②20℃时,
饱和溶液中溶质与溶剂的质量比为。
Ⅱ.某
样品中含有少量
,其提纯流程如下:

(1)溶液A加入适量
溶液,与溶液中
恰好完全反应,生成
沉淀和
,写出该反应的化学方程式:。
(2)操作a的名称是。
(3)20℃时溶液C是(填"饱和溶液"或"不饱和溶液")。
右图是甲、乙两种固体物质的溶解度曲线,请回答:
(1)在______℃时,甲、乙两物质的溶解度相等。
(2)在40℃,等质量的甲、乙两种物质的饱和溶液,当温度降低到20℃时,析出晶体较多的是_______________(填甲或乙)
右图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)t2℃时a、b、c三种物质的溶解度由小到大的顺序是 (填序号,下同);
(2)t2℃时100g a物质加入到100g水中不断搅拌,形成的溶液的质为 g;
(3)将t2℃时a、b、c三种物质得到饱和溶液降低温度到 t1℃时,这三种溶液的溶质质量分数的大小关系是 。
试题篮
()