右图为A、B、C三种固体物质的溶解度曲线。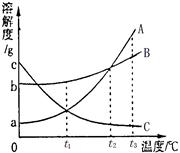
(1)在某一温度时,A、B两饱和溶液的溶质质量分数
相等,此时为_____℃。
(2)在t3℃时,15g水最多能溶解5gB物质,则15g水最多能溶解A物质的质量_______5g。(填“>”、“<”或“=”)
(3)三种物质的溶解度关系为B>A>C时的温度为t℃,则t的取值范围是____________。
(4)将A、B、C饱和溶液从t3℃降温到0℃时,溶质质量分数保持不变的是_________。
现有A物质和B物质在所测试温度下的溶解度如下表:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
| 溶解度/g |
A |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
| B |
13.3 |
31.6 |
63.9 |
110.0 |
169.0 |

(1)根据测出的A、B两物质溶解度数据,描出粗略的溶解度曲线。
(2)从两物质的溶解度曲线看出,随温度变化溶解度变化不大的物质是_______;在100g水中要溶解85gB物质,温度大约在_____℃时才可能溶解完。
图为A、B两种物质的溶解度曲线。
(1)曲线上Q点表示 ;
(2)在20℃时两种物质的饱和溶液中溶质的质量分数为A B(选填“﹥”、“﹦”、“﹤” )各为 ;(精确到0.1%)
(3)30℃时,将10gA物质加入到盛有100g水的烧杯中,充分搅拌,得到不饱和溶液,若再加入A物质 g或降温到 ℃,都能恰好形成饱和溶液。
甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题:
(1)50℃时,乙物质的溶解度是 g.
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为 .
(3)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最
小的是 .
(4)要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是 .
下图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 。P点所表示的含义为 。
(2)保持t2℃温度不变,将B物质的不饱和溶液转变成饱和溶液可采取的方法有 。
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的 。
右图是甲、乙两种物质的溶解度曲线。
(1)t2℃时,溶解15g甲物质,至少需要 g水。
(2)t2℃时,在烧杯中分别盛有等质量的甲、乙两种溶质的饱和溶液,从t2℃降温到t1℃时,对烧杯中剩余溶液描述正确的是 。
a.溶质的质量分数:甲>乙 b.析出固体的质量:甲>乙
c.甲是饱和溶液,乙是不饱和溶液 d.溶剂的质量:甲﹤乙
I、图是甲、乙两种固体物质的溶解度曲线,请结合图回答问题:
⑴ ___________℃时,甲物质与乙物质的溶解度相等。
⑵ 使甲物质从60℃的饱和溶液中结晶析出的最好方法是___________________。
⑶ 80℃时,将等质量的甲、乙两种物质分别加入盛有100g水的烧杯中充分溶解,观察到的现象如图所示。____________(填A或B)烧杯中的溶液一定达到饱和状态,溶质的质量分数为____________。要使A烧杯中的剩余的固体继续溶解可采用的一种方法是__________________________。
II、 锶元素的粒子结构示意图和在元素周期表中的信息如图所示: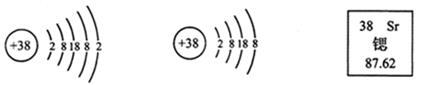
(1)锶属于 (填“金属”或“非金属”)元素。
(2)锶元素相对原子质量为 。
(3)从图中可获取的一条信息是 。
(4)图所表示的微粒的化学符号是 。
右图是 A、B、C三种物质的溶解度曲线,回答下列问题:
(1)t3℃时,A的溶解度溶解度为
(2)________℃时,A、C的溶解度相等.
(3)如果A物质中混有少量B物质,可用 的方法得到较纯
的A物质。
(4)在t2℃时,将200gB物质的饱和溶液蒸发10g水,可析出晶体B(不含结晶水) g。
(5)t2℃的等质量A、B两种物质的饱和溶液分别降温到t1℃析出晶体多的是___________物质。
(6)在t2℃时,向50克的水中加入25克A物质,充分溶解后所得的溶液为_____________(填“饱和溶液”或“不饱和溶液”),形成溶液的溶质质量分数_________。
向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
⑴烧杯中的溶液一定属于饱和溶液的是 (填序号);
⑵图二能表示NaNO3溶解度曲线的是 (填“甲”或“乙”);
⑶由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的 (填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
某化学兴趣小组的同学在20℃时进行了如下图所示实验。
根据右图KNO3的溶解度曲线,结合实验回答相关问题:
(1)50℃时,100 g水最多可溶解硝酸钾的质量为 g。
(2)充分搅拌后。可观察到:A中无剩余固体,B中 。
(3)A—E的溶液中,溶质质量分数相等的是 。(填字母)
下表是氯化钠和硝酸钾在不同温度时的溶解度
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
(1)用纵坐标表示溶解度,横坐标表示温度,根据上表所提供的数据,在右图的坐标纸上绘制两种物质的溶解度随温度变化的曲线——溶解度曲线。
(2)从绘制的溶解度曲线上查出在25℃时,硝酸钾的溶解度为 g
(3)在 ℃时,两种物质饱和溶液的溶质质量分数相等。
(4)从图中看出,要除去硝酸钾中混有的少量氯化钠,可采用的方法是 。
图为甲、乙两种固体物质在水中的溶解度曲线:
⑴当40℃时,两物质的溶解度的关系是___________。
⑵在60℃时,有等质量的甲、乙饱和溶液,当温度降至20℃时,有固体析出的是:_________。
⑶在80℃时,将45克甲物质放到50克水中,形成的是 (填“饱和”或“不饱和”)溶液。
⑷欲使甲的不饱和溶液A变为饱和溶液且不改变溶质质量分数的方法是 。
右图是常见固体物质的溶解度曲线,根据图示回答:
(1)对A物质来说,a点的意义是 。
(2)将t1℃140 g A的饱和溶液升温至t2℃时,此时溶液是 (填“饱和”或“不饱和”)状态,然后再加入A物质40 g,可用曲线上的 点表示。t2℃时A、B、C三种物质饱和溶液的质量分数由大到小的顺序是 。
(3)若将d点温度下A、B、C三种物质的饱和溶液降温至t1℃,没有晶体析出的是 物质。
结合如图的溶解度曲线图回答问题.
(1)欲配制100g 0.9%的生理盐水,需要NaCl的质量为 _________ g.
(2)由右图可知,硝酸钾的溶解度随温度升高而 _________ ;P点表示的意义是 _________ .
(3)若从氯化钠和硝酸钾的饱和溶液中提取硝酸钾,应采用下列方法中的 _________ (填字母代号).
a.冷却结晶 b.蒸发结晶.
从右图中,可以获得多项与甲、乙两物质溶解度有关的信息:
(1)在t2℃时,向50mL水中加入18g甲物质,充分溶解后可得到溶液 g,是 (选填“饱和”或“不饱和”)溶液;
(2)如甲物质中混有少量乙,可以用 方法提纯;
(3)两曲线的交点A表示 ;
(4)你还能获得的一项信息是: 。
试题篮
()