以下是KCl的部分溶解度数据,下列说法中正确的是
| 温度(℃) |
0 |
20 |
40 |
60 |
| 溶解度(g/100g水) |
27.6 |
34.0 |
40.0 |
45.5 |
A.KCl饱和溶液中不能再溶解其他物质
B.20℃时,100 g KCl饱和溶液中含KCl 34.0 g
C.20℃的KCl溶液的浓度一定小于 40℃的KCl饱和溶液的浓度
D.60℃时,将一定质量分数KCl溶液降温到40℃,一定有晶体析出
下列关于气体溶解度的说法正确的是
| A.气体的溶解度和固体一样只随温度的变化而变化。 |
| B.压强增大,气体溶解度减小。 |
| C.压强增大,气体溶解度增大。 |
| D.温度升高,气体溶解度增大。 |
a、b、c三种物质在水中的溶解度曲线如图所示,下列有关叙述错误的是
| A.c物质属于易溶性物质 |
| B.20℃时,将10g b溶解在100g水中得110g不饱和溶液 |
| C.20℃时,a物质在水中的溶解度是10g |
| D.50℃时a和b的两杯饱和溶液至20℃,析出a一定比b多 |
A物质的溶解度资料如下表。向100g水中不断加入固体A或改变温度,得到相应的溶液①——⑤的流程如图。根据溶解度资料与实验过程,回答下列问题。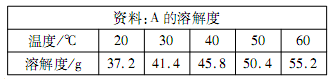
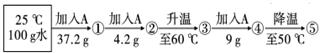
Ⅰ.画出A物质的溶解度曲线。(23)
Ⅱ.25℃时,A物质的溶解度约为 (24) g;
溶液①——⑤中属于饱和溶液的是 (25) (填写编号)。溶液③的溶质质量分数是 (26) 。
Ⅲ.溶液⑤继续降温至30℃,可析出A物质 (27) g。
甲、乙两种固体(不含结晶水)的溶解度曲线如图所示,请回答:
①35℃时,甲的溶解度为 g/100g水。
②25℃时,将40g甲放入100g水中,充分溶解并恢复至25℃,得到溶液的质量为 g。
③甲溶液中混有少量乙时,可通过 的方法提纯甲。
Ⅰ.降温结晶 Ⅱ.蒸发结晶 Ⅲ.过滤
④25℃时,将200g甲物质的饱和溶液恒温蒸发少量水,析出2g晶体,则剩余溶液的溶质质量分数为 。
20℃时,根据某固体在不同质量的水中达饱和时溶解的质量绘成如图斜线,有关说法正确的是
| A.20℃时该物质的溶解度为40 |
| B.d点对应溶液的溶质质量分数为20% |
| C.该物质的溶解度随温度的升高而增大 |
| D.a~d点对应溶液的溶质质量分数关系是:d<c<a=b |
下图为硝酸钾和氯化钠的溶解度曲线。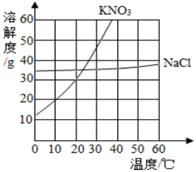
由图可知:(1)当温度为30℃时,硝酸钾的溶解度 (填“>”、“<”或“=”)氯化钠的溶解度。
(2)当硝酸钾中含有少量氯化钠时,可用 法提纯硝酸钾。
(3)硝酸钾、氯化钠都属于 (填“易溶”、“可溶”、“微溶”或“难溶”)物质。
(4)10℃时,将12g硝酸钾加入50g水中不断搅拌,形成溶液是 (填“饱和”或“不饱和”)溶液,溶液质量为 。
右图是a、b、c三种物质的溶解度曲线图,a与c的溶解度曲线相交于P点。请回答:
(1)t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是
(填写序号)。
(2)t1℃时,15g a物质加入到50g水中充分搅拌,能形成 g溶液。
如图所示,甲、乙是两种物质的溶解度曲线,下列叙述正确的是
| A.40℃时,在100g水中加入30g甲,充分溶解后溶液的质量是130g |
| B.甲物质的溶解度大于乙物质的溶解度 |
| C.采用降温的方法可将乙的不饱和溶液转化为饱和溶液 |
| D.20℃时乙的溶解度大于甲的溶解度 |
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14[ |
0.12[ |
0.09 |
0.08 |
| NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。

(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。
物质的溶解度不同,用途也不同。请据表回答:
表一 物质的溶解度(20℃)
| 物质 |
NaOH |
Ca(OH) 2 |
CaCO 3 |
CaSO 3 |
| 溶解度(克) |
109 |
0.165 |
0.0014 |
0.0043 |
表二 物质在水中的溶解性等级
| 20℃时的溶解度(克) |
>10 |
1-10 |
0.01-1 |
<0.01 |
| 等级 |
易溶 |
可溶 |
微溶 |
难溶 |
(1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳主要原因是氢氧化钙 于水,吸收效果不好。
(2)实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明 。
(3)20℃时,饱和氢氧化钠溶液的溶质质量分数为 。(精确到0.1%)
甲、乙两种固体物质的溶解度曲线如图.下列说法不正确的是
| A.t2℃时,要使接近饱和的乙溶液达到饱和状态,可以用加溶质的方法 |
| B.甲物质中含有少量乙,可采用降温结晶的方法提纯甲 |
| C.t1℃时,50g甲的饱和溶液中溶解了10g的甲 |
| D.将t2℃时的甲、乙两物质的饱和溶液升温至t3℃(溶剂的量不变),两溶液中溶质的质量分数相等 |
课本中的图表、数据等可以提供很多信息。下面有关的说法不正确的是
| A.根据相对分子质量可比较相同状况下气体的密度大小 |
| B.根据金属活动性顺序表,可以帮助判断金属在溶液中的置换反应能否发生 |
| C.根据某元素的原子结构示意图可判断该元素原子核内中子的数目 |
| D.根据溶解度曲线图,可确定从溶液中析出晶体的方法 |
下图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
| A.NaCl的溶解度不受温度的影响 |
| B.t1℃时,100gKNO3饱和溶液中含有20gKNO3 |
| C.t2℃时,NaCl饱和溶液与KNO3饱和溶液中溶质的质量一定相等 |
| D.温度高于t2℃时,KNO3的溶解度大于NaCl的溶解度 |
试题篮
()