甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
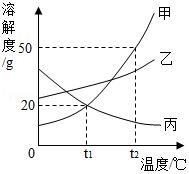
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
根据图示实验,下列说法正确的是( )

A.氯化钠溶液不能溶解其他溶质
B.20mL水中溶解氯化钠的最大质量是定值
C.加热后溶液中硝酸钾的质量分数变大
D.加热后硝酸钾溶液是不饱和溶液
甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
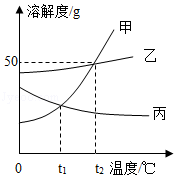
A.t 1℃时,甲和丙的溶解度相等
B.降低温度可使丙的不饱和溶液变成饱和溶液
C.甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.t 2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
溶解度/克 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
A.20℃时,100克水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克
C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
D.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小
高氯酸钾( KClO4) 可用作火箭推进剂,其溶解度如表。下列说法不正确的是( )
温度/℃ |
20 |
40 |
60 |
80 |
溶解度/g |
1.68 |
3.73 |
7.3 |
13.4 |
A.高氯酸钾的溶解度随温度降低而减小
B.20℃时,将 2g高氯酸钾溶于98g水中,所得溶液中溶质的质量分数小于2%
C.60℃时,高氯酸钾饱和溶液中溶质的质量分数小于7.3%
D.80℃的高氯酸钾溶液冷却至40℃肯定有晶体析出
如图是甲乙两种物质的溶解度曲线。下列说法正确的是( )

A.甲的溶解度比乙的溶解度大
B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液
C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同
D.将a1℃时甲、乙同种物质的饱和溶液升温至a2℃,溶质的质量分数都增大
硝酸钾在不同温度下的溶解度数据如下表所示:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
| 溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
回答下列问题:
(1)20℃时,将18g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量是 g。
(2)80℃时,将269g硝酸钾饱和溶液降温到60℃,析出晶体的质量是 g。
(3)0℃时,硝酸钾饱和溶液中溶质的质量分数是 。(结果精确到0.1%)
(4)将40℃的硝酸钾饱和溶液变为不饱和溶液,可采取的措施是 。
根据下表信息,相关说法正确的是( )
温度/℃ |
溶解度/g |
|||
NaCl |
KCl |
NH4Cl |
KNO3 |
|
20 |
36.0 |
34.0 |
37.2 |
31.6 |
40 |
36.6 |
40.0 |
45.8 |
63.9 |
60 |
37.3 |
45.5 |
55.2 |
110 |
A.20℃时,NaCl的溶解度为36.0
B.40℃时,KCl饱和溶液的溶质质量分数为40%
C.40℃时,向100g水中加入50gNH4Cl充分溶解,溶液质量为145.8g
D.60℃时降温到20℃时,KNO3和KCl的饱和溶液析出晶体较多的是KNO3
水是“生命之源”,钓鱼岛水域的海水及海洋资源是极其丰富的。
(1)钓鱼岛附近水域海底蕴藏大量的天然气,其主要成分是 (填化学式)。
(2)我国渔民在这一带从事捕鱼作业,鱼类含有丰富的营养价值,主要为人的生命活动提供丰富的 (填字母序号)营养物质。
A.糖类B.油脂C.蛋白质D.维生素
(3)某渔民从钓鱼岛附近水域带回一瓶海水,加入肥皂水振荡,产生了大量泡沫,则该海水属于 (填“硬水”或“软水”)。
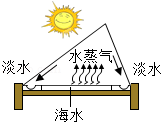
(4)海水淡化可缓解淡水资源匮乏的问题。图为太阳能海水淡化装置示意图。
①水变成水蒸气的过程中,不发生变化的有 (填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会 (填“变大”、“变小”或“不变”)。
(5)河水同海水一样也不能直接饮用,要经过净化才能成为饮用水。自来水厂净化水采取的操作方法有 (填字母序号)。
A.沉淀 B.过滤 C.吸附 D.蒸馏
(6)电解水实验揭示了水的组成。右图实验中得到氢气的试管是 (填“A”或“B”)。

某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在与t2℃的 (填“饱和”或”不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至 ℃。
(3)t2℃时,若M点所示溶液的质量为70g,其中含溶质 g.再将该溶液降温到t1℃,溶液的溶质质量分数变为 (保留一位小数)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是 (填字母)
A.M、N点均不动
B.M、N点均垂直上移
C.M点沿曲线下移;N点垂直上移
D.M点不动;N点垂直上移至曲线,不再变动

水在自然界、生产和生活中都有广泛用途.
(1)硬水和软水常用 来区分,软化硬水的方法很多,日常生活中常用 法
(2)在水的净化过程中,常利用 (填物质名称)的吸附性除去水中异味,高铁酸钾(化学式K2FeO4)是一种新型净水剂,可用于自来水净化处理,高铁酸钾中铁元素的化合价为 价.
(3)水是重要的溶剂,配制2%的氯化钠溶液500g,不需要使用的仪器是 (填写字母代号)
A.酒精灯 B.玻璃棒 C.烧杯 D.量筒 E.托盘天平
(4)除去NaOH溶液中混有的少量Na2CO3杂质,需加入适量的 溶液至不再产生沉淀为止,然后过滤,将滤液 得到NaOH固体.
(5)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO.一段时间后得到同温度的溶液乙;甲、乙溶液中溶质质量甲 乙(填“>、<、=”)
30℃时将等质量的两份饱和石灰水,一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃.则两种情况下均不改变的是( )
A.溶剂的质量B.溶质的质量
C.溶质的溶解度D.溶液中溶质的质量分数
溶液对于自然界中的生命活动和人类生产活动具有重要意义,如图是甲、乙、丙三种固体物质的溶解度曲线(固体均不含结晶水),下列说法不正确的是( )

| A. |
甲中混有少量乙,可采用降温结晶的方法提纯甲 |
| B. |
t 1℃时,将20g甲加入50g水中充分溶解后可得到70g溶液 |
| C. |
t 1℃时,等质量的甲和乙固体形成饱和溶液时所需水的质量关系:甲>乙 |
| D. |
将t 2℃时甲、乙、丙三种物质的饱和溶液降温至t 1℃,所得溶液的溶质质量分数关系:乙>甲=丙 |
水和溶液在生产生活中用途广泛,请回答下列问题。
(1)自来水厂在净化水的过程中加入明矾的作用是 (填“杀菌”或“使悬浮物沉淀”);水能灭火的主要原因是 。
(2)生活中的下列物质属于溶液的是 (填字母序号,下同)。
A.白酒
B.豆浆
C.糖水
D.泥浆
(3)在2021年全国两会上,“蓝天、碧水、净土保卫战”成为聚焦重点,下列符合这一目标的是 。
A.生活污水任意排放
B.工业废水坚持达标排放
C.大量使用农药和化肥,增加农作物产量
D.农业上改漫灌为滴灌
(4)t2℃时,向盛有10mL水的Ⅰ、Ⅱ两支试管中分别加入等质量的甲、乙两种固体,充分溶解后,观察到如图1所示的现象。图2是甲、乙两种固体的溶解度曲线。请回答:
①图2中表示甲物质溶解度曲线的是 (填“a”或“b”)。
②根据图2分析,下列说法正确的是: 。
A.乙中混有少量甲,可用降温结晶法提纯乙
B.等质量甲、乙饱和溶液由t2℃降温至t1℃,所得溶液溶质质量分数相等
C.升温可使甲的饱和溶液变为不饱和溶液
D.t1℃时,将20g甲物质加入50g水中充分溶解,得到70g溶液

试题篮
()